
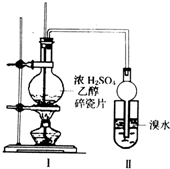
 某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.分析 验证产物中有乙烯生成且乙烯具有不饱和性流程:装置I:在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑,因浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,C+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,干扰乙烯具有不饱和性性质验证,装置II:连接球形干燥管,防止倒吸,如果发生取代反应生成物含有HBr,溶液酸性增强,若发生加成反应,水溶液PH将增大,可用PH试纸来测试反应后溶液的酸碱性变化进行确认.
(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯;
(2)浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,二氧化硫含有还原性;
(3)乙烯和溴发生加成反应生成溴代烃,溴代烃不溶于水且密度大于水;如果发生取代反应生成物含有HBr,溶液酸性增强,若发生加成反应,水溶液PH将增大.
解答 解:(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,自身被还原生成二氧化硫,C+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,
故选:BC;
(3)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水在试管底层为油状物质;根据取代反应的原理,如果发生取代反应必然生成HBr使溶液酸性增强,pH变小,溴水成酸性,1,2-二溴乙烷为中性,若发生加成反应,水溶液PH将增大,
故答案为:观察到试管内液体分层,下层为油状液体;若发生取代反应必然生成HBr使溶液酸性增强,pH变小,若发生加成反应,水溶液PH将增大.
点评 本题考查了实验室制取乙烯实验,明确实验原理是解本题关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
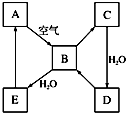 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B物质的量浓度 | B. | 混合气体的密度 | ||
| C. | 混合气体的压强 | D. | 混合气体的平均相对分子量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用酸式滴定管量取25.00ml稀硫酸 | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用托盘天平称量15.42gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
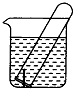 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| ① | 将Fe投入硫酸铜溶液中; | 验证Fe的金属性比Cu强. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com