
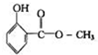
 冬青油结构如图,它在一定条件下能发生的反应有:( )
冬青油结构如图,它在一定条件下能发生的反应有:( )| A. | ①②⑥ | B. | ①②③ | C. | ④⑤⑥ | D. | ①②④ |
科目:高中化学 来源: 题型:选择题
| A. | 两容器中分子间的平均距离不相同 | |
| B. | 两容器中所含微粒的质量均相同 | |
| C. | 两容器中所含原子数、分子数、中子数均相同 | |
| D. | 两容器中所含质子数、中子数均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
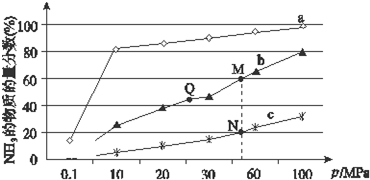
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜板作阳极 | |
| B. | 电解时,阴极反应为Cu2++2e-=Cu | |
| C. | 电解铜的纯度可达99.95%~99.95% | |
| D. | 粗铜中所含的锌、镍、银等,电解后均以单质形式沉积槽底 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同周期元素中,随着原子序数的递增,原子半径逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 同一主族元素,随着原子序数的递增,其单质的熔沸点依次升高 | |
| D. | 随着卤素原子半径的增大,其气态氢化物稳定性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、O、F最高正价依次升高 | |
| B. | Al3+、Na+、O2-微粒半径依次增大 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
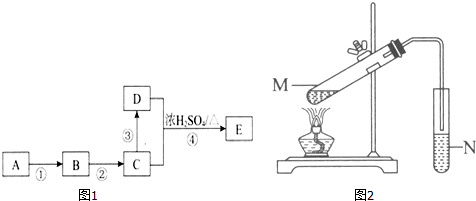
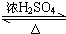 CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.
CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红色、紫色、红色 | B. | 黄色、红色、无色 | C. | 黄色、紫色、无色 | D. | 黄色、紫色、红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不需要通过化学反应就能从海水中获得食盐和淡水 | |
| B. | 潜水艇在紧急情况下可用过氧化钠供氧 | |
| C. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| D. | 工业上常用硅制造光导纤维;用铝粉还原一些金属氧化物来制金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com