
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | △H>0表示产物的总能量低于反应物的总能量 | |
| C. | △H 的单位kJ•mol-1,热量Q的单位为kJ | |
| D. | 化学键断裂过程中释放能量 |
分析 化学变化的实质是有旧化学键的断裂和新化学键的形成,化学键断裂吸收能量,形成化学键放出能量,伴随着能量的变化,且吸热反应、放热反应与是否加热才能进行无关,△H 的单位kJ•mol-1,以此解答该题.
解答 解:A.需要加热才能发生的反应不一定为吸热反应,也可能为放热反应,如铝热反应在高温下才能进行,故A错误;
B.△H>0为吸热反应,表示产物的总能量高于反应物的总能量,故B错误;
C.△H 为反应热,单位kJ•mol-1,热量Q的单位为kJ,故C正确;
D.化学键断裂过程中吸收能量,故D错误.
故选C.
点评 本题考查了化学反应能量变化的实质和分析判断,为高频考点,主要是反应实质的理解应用,注意相关基础知识的积累,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
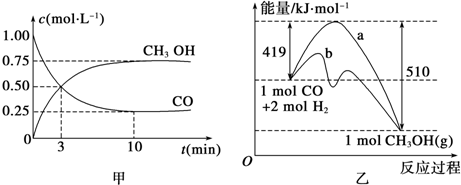
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应②中,反应物的键能大于生成物的键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当光束通过下列分散系:有尘埃的空气、豆浆、墨水都能观察到丁达尔效应 | |
| B. | 溶液、胶体、浊液的根本区别是分散质微粒直径的大小 | |
| C. | 把1mL0.1mol/L三氯化铁溶液滴加入20mL沸水中,边加边振荡,可制得氢氧化铁胶体 | |
| D. | 胶体的稳定性介于溶液和浊液之间,属于介稳体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: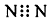 | B. | S2-的结构示意图: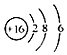 | ||
| C. | HF的电子式: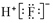 | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过煤的气化和液化获得洁净的燃料 | |
| B. | 加快核能、太阳能、沼气等新能源的开发利用 | |
| C. | 减少资源消耗,注重资源的重复使用、资源的循环再生 | |
| D. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
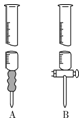 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com