
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年来,我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+ H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2= -90.0 kJmol-1
CH3OH(g) ΔH2= -90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式_________。
(2)为提高CH3OH产率,理论上应采用的条件是_________(填字母)。
a 高温高压 b 低温低压 c 高温低压 d 低温高压
(3)250℃、在体积为2.0 L的恒容密闭容器中加入6 mol H2、2 mol CO2和催化剂,10 min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10 min的平均反应速率v(H2)=______ mol·L-1·min-1。
② 化学平衡常数的值 ______。
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入_____。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的Δ H_____(填“变大”“变小”或“不变”)。
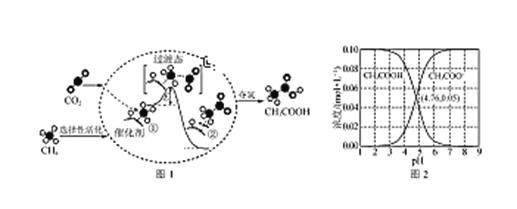
(5)CO2还可以与CH4反应生成CH3COOH。反应历程如下图1。(中间体的能量关系如虚框中曲线所示) 室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线,如下图2。
①中间体①的能量______中间体②的能量。(填:“>”或“=”或“<”)
②从图2中得出,室温下,CH3COOH的电离常数值为____。
【答案】CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-48.9kJ/mol d 0.225 5.3 1mol CO2(g)+3mol H2(g) 不变 > 10-4.76
【解析】
(1)利用已知热化学方程式,求出CO2催化氢化合成甲醇的热化学方程式。
(2)该反应为体积缩小的放热反应,所以应加压、降温。
(3)利用三段式,可计算出反应速率及平衡常数。
(4)催化剂能加快反应速率,但不能改变反应的热效应。
(5)从图中可看出两中间体的能量关系;找出图中的特殊点,可计算出电离常数。
(1)已知:CO2(g)+ H2(g)![]() H2O(g)+CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g)+CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2= -90.0 kJmol-1
CH3OH(g) ΔH2= -90.0 kJmol-1
将两热化学方程式相加,即可得出CO2催化氢化合成甲醇的热化学方程式:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H=-48.9kJ/mol,
答案:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-48.9kJ/mol。
(2)因为此反应为放热的体积缩小的可逆反应,所以为提高CH3OH产率,理论上应采用的条件是加压、降温;
答案:d。
(3) CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量 1mol/L 3mol/L 0 0
变化量 0.75mol/L 2. 25mol/L 0.75mol/L 0.75mol/L
平衡量 0.25mol/L 0.75mol/L 0.75mol/L 0.75mol/L
① 前10 min的平均反应速率v(H2)=![]() mol·L-1·min-1;
mol·L-1·min-1;
答案:0.225。
② 化学平衡常数的值![]() ;
;
答案:5.3。
(4)① 图中A处应填入1mol CO2(g)+3mol H2(g);
答案:1mol CO2(g)+3mol H2(g)。
② 因为催化剂不能改变反应物的转化率,所以加入催化剂后,该反应的Δ H不变;
答案:不变。
(5)①从图中可以看出,中间体①的能量>中间体②的能量;
答案:>
②我们选择两条曲线的交叉点,在此点c(CH3COO-)= c(CH3COOH),且c(H+)=10-4.76,
室温下,CH3COOH的电离常数值为![]() ;
;
答案:10-4.76


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.28g氮气所含有的原子数目为NA
B.标准状况下,22.4L水中含有个水分子NA
C.2NA个氯气的体积是NA个氧气的体积的2倍
D.标准状况下,22.4L氯化氢所含的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由水电离出的c(H+)=1×10-12molL-1的溶液中,一定能大量共存的离子组是( )
A.NH![]() 、Ba2+、NO
、Ba2+、NO![]() 、Cl-B.Cl-、SO
、Cl-B.Cl-、SO![]() 、Na+、K+
、Na+、K+
C.SO![]() 、NO
、NO![]() 、Fe2+、Mg2+D.Na+、K+、ClO-、I-
、Fe2+、Mg2+D.Na+、K+、ClO-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)为主要原料生产锰酸锂(LiMn2O4)的工艺流程如下:
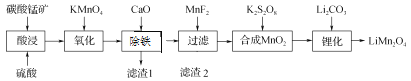
已知:部分离子沉淀的pH值。
离子 | 开始沉淀的pH值 | 沉淀完全时的pH值 |
Mn2+ | 8.8 | 10.8 |
Fe2+ | 7.5 | 9.5 |
Fe3+ | 2.2 | 3.5 |
(1) 为了提高碳酸锰矿浸岀的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_____等。
(2) 氧化时发生的离子方程式:_________。
(3) 加入CaO“除铁”的原理是____________。
(4) 加入MnF2为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为________mol·L-1[常温时,Ksp(CaF2)=2.7×10-11]。
(5) “锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5 h,然后升温至600~750 ℃,保温24 h,自然冷却至室温得产品。升温到515 ℃时,开始有CO2产生,比预计碳酸锂的分解温度(723 ℃)低得多。可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50molL-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
实验步骤 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电解质在水溶液中的平衡能了解它的存在形式,有重要的实际意义。

(1)常温下,向100mL0.01mol·L-1HA的溶液中逐滴加入0.02mol·L-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
①常温下,0.01mol·L-1HA溶液中由水电离出的c(H+)=_____mol·L-1。
②常温下一定浓度的MA稀溶液的pH=a,则a____7(填“>”、“<”或“=”),用离子方程式表示其原因为_____。
③X点时,溶液中c(H+)、c(M+)、c(A-)由大到小的顺序是_____。
④K点时,溶液中c(H+)+ c(M+)- c(OH-)=____molL-1。
(2)25 ℃时,已知Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5。取浓度均为0.100 0 mol·L-1的醋酸溶液和氨水溶液各20.00 mL于锥形瓶中,分别用0.1000 mol·L-1NaOH溶液、0.1000 mol·L-1盐酸进行滴定,滴定过程中pH随滴加溶液体积变化关系如图所示。
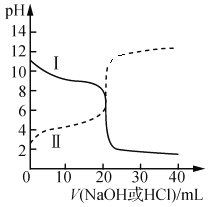
①从曲线I可知,该滴定操作时,应选______作为指示剂。
②在曲线Ⅱ,当滴加溶液到10.00 mL时:
c(CH3COO-)+c(OH-) ___ c(H+)+c(CH3COOH) (填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:
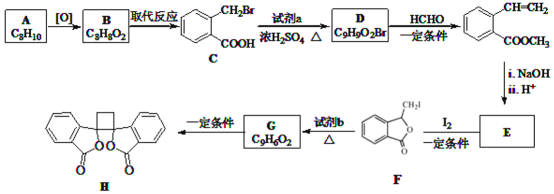
已知:
![]()
![]() R—HC=CH—R’
R—HC=CH—R’
ii.R—HC=CH—R’![]()
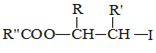
iii.R—HC=CH—R’![]()
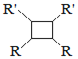
![]() 以上R、
以上R、![]() 、
、![]() 代表氢、烷基或芳基等
代表氢、烷基或芳基等![]()
![]() 属于芳香烃,其名称是______。
属于芳香烃,其名称是______。
![]() 的结构简式是______。
的结构简式是______。
![]() 由F生成G的反应类型是______。
由F生成G的反应类型是______。
![]() 由E与
由E与![]() 在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
![]() 下列说法正确的是______
下列说法正确的是______![]() 选填字母序号
选填字母序号![]() 。
。
A.G存在顺反异构体
B.由G生成H的反应是加成反应
C.1molG最多可以与1mol![]() 发生加成反应
发生加成反应
D.1molF或1molH与足量NaOH溶液反应,均消耗2molNaOH
![]() 以乙烯为起始原料,结合已知信息选用必要的无机试剂合成
以乙烯为起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路线
,写出合成路线![]() 用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件
用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件![]() 。______。
。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 124 g P4含有P—P键的个数为4NA B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA D. 60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,分别用0.1mol/L溶液进行下列实验,结论不正确的是![]()
![]()
A.向![]() 溶液中通
溶液中通![]() 至
至![]() :c(Na+)=c(HCO3-)+ 2c(CO32-)
:c(Na+)=c(HCO3-)+ 2c(CO32-)
B.向![]() 溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-)
溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-)
C.向![]() 溶液中加入等浓度等体积的
溶液中加入等浓度等体积的![]() 溶液:pH=13
溶液:pH=13
D.向氨水中加入少量![]() 固体:
固体:![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com