
【题目】物质的量浓度均为0.100mol/L的下列物质的溶液中,c(NH4+)最大的是( )
A.NH4ClB.NH4HSO4C.NH3·H2OD.CH3COONH4
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的判断正确的是( )
A. 60℃时,NaCl溶液的pH<7,则溶液呈酸性
B. 将pH=4的CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小
C. 常温下,CH3COOH分子可能存在于pH>7的碱性溶液中
D. 相同温度下,1 mol·L-1氨水与0.5 mol·L-1氨水中c(OH-)之比是2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH。
CH3OH(g) ΔH。
(1)能判断反应达到平衡状态的依据是__________(填字母序号)。
A.2 ν逆(H2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
F、CO、H2、CH3OH的速率之比为1:2:1
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H_______0(填“>”或“<”)。

(3)一定温度下,将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为_______________。
②若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是_______________(“正向移动”“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的![]() ,与原平衡相比,下列有关说法正确的是_____________(填字母)。
,与原平衡相比,下列有关说法正确的是_____________(填字母)。
A.H2的浓度减小; B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加; D.重新平衡时, ![]() 增大;
增大;
(4)上图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A_________ C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_________ C,由状态B到状态A,可采用_____________的方法(填“升温”或“降温”)。
(5)如图是一定的温度和压强下![]() 和
和![]() 反应生成1 mol
反应生成1 mol ![]() 过程中能量变化示意图,请写出工业合成氨的热化学方程式__________________
过程中能量变化示意图,请写出工业合成氨的热化学方程式__________________![]() H的数值用含字母
H的数值用含字母![]() 、Q
、Q![]() 的代数式表示)。
的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为:锌片:Zn+20H--2e-=ZnO+H20 石墨:02+2H20+4e-=40H-根据此判断,锌片是
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是—种极强的氧化剂,常应用于饮用水处理,其工业制备方法如图所示:

(1)高铁酸钾中铁元素的化合价是__________价。
(2)反应I的目的是________________________________。
(3)反应II的离子方程式为________________________________。
(4)洗涤粗品时选用乙醇而不用水的理由是________________________________。
(5)己知生成高铁酸钾的反应为Na2FeO4+2KOH![]() K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
(6)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以及改善水质,其消毒原理是______________________。
(7)可用亚铬酸盐滴定法测定高铁酸钾含量,滴定时有关反应的离子方程式为:
①FeO42-+CrO2-+2H2O==CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+=CrO72-+H2O
③CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
现称取2.084g高铁酸钾样品溶于适量NaOH溶液中,加入稍过量的NaCrO2,充分反应后过滤,滤液在250mL容量瓶中定容。每次取25.00mL加入稀硫酸酸化,用0.1000mol·L-1的FeSO4标准溶液滴定,三次滴定消耗标准溶液的平均体积为20.00mL。则上述样品中K2FeO4 的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的前四周期元素,A是周期表中原子半径最小的元素,它们组成的单质或化合物有如图转化关系,其中甲、丙和戊是单质,乙、丁和己是氧化物,其中丁是两性氧化物,戊是紫红色金属。请回答下列问题:

(1)D元素的元素符号为______________,C元素在周期表中的位置为_____________。
(2)用电子式表示己的形成过程_____________。
(3)反应①在工业生产中通常称作_____________反应。
(4)甲、戊与浓硝酸可形成原电池,其中________________(填化学式)作负极,正极电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室制取CO2气体的过程中,不慎用到了浓盐酸,导致制得的CO2气体中混有氯化氢气体,他们设计了如下除去氯化氢气体并探究CO2与过氧化钠(Na2O2)反应的实验. 查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O发生反应:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2H2O═4NaOH+O2↑
请回答下列问题: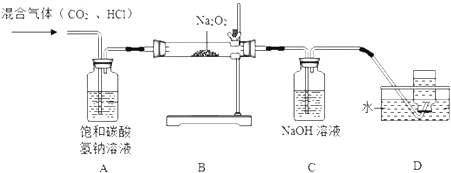
(1)装置A的作用是 .
(2)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含 , 该小组同学继续进行探究.
(3)【提出问题】反应后硬质玻璃管中固体的成分是什么? 【做出猜想】猜想一:Na2CO3猜想二:NaOH 猜想三:Na2CO3和NaOH
经过讨论,大家一致认为猜想不合理,理由是 .
(4)【实验验证】小组同学取上述形成的溶液M于试管中,向其中加入过量的溶液,若产生白色沉淀,过滤,向滤液中滴加几滴酚酞试液,溶液变红,则证明猜想三成立.
(5)【交流反思】小组中有同学认为,将上述滤液中滴加的酚酞试液换成硝酸铜溶液,也能得出同样的结论, 你认为该同学的观点(填“正确”或“错误”),理由是 .
(6)【拓展延伸】在盛有氯化铵(NH4Cl)浓溶液的试管中,加入足量的过氧化钠(Na2O2)固体,有气泡产生,产生的气体是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
A. 化合物KCrO2中Cr元素为+3价
B. 实验①证明Cr2O3是两性氧化物
C. 实验②证明H2O2既有氧化性又有还原性
D. 实验③证明氧化性: Cr2O72-> I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒
B.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣个数为1NA
C.25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA
D.常温下,23 g NO2含有2NA个氧原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com