
在下列变化过程中,既有离子键被破坏又有共价键被破坏的是 ( )
A.将SO2通入水中 B.烧碱溶于水
C.将HCl通入水中 D.硫酸氢钠溶于水
科目:高中化学 来源: 题型:
将淀粉浆和淀粉酶的混合物放入半透膜袋中,扎好后浸入流动的温水中,经过足够长的时间,取出袋内的液体,分别与①碘水 ②新制Cu(OH)2加热 ③浓硝酸(微热)作用,其现象依次是 ( )。
A.显蓝色;无砖红色沉淀;显黄色
B.不显蓝色;无砖红色沉淀;显黄色
C.显蓝色;有砖红色沉淀;不显黄色
D.不显蓝色;有砖红色沉淀;不显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组的同学在学习了氨气的性质后讨论:既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列实验:
Ⅰ.制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体混合物的方法来制取氨气。写出实验室制取氨气的化学方程式:__________________________________。
(2)实验室还可向____________(填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的?________(填“能”或“否”),理由是_____________________________。
Ⅱ.实验探究
该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出)探究氨气的还原性(生成Cu和无污染的物质):
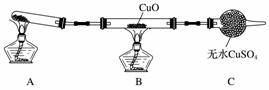
(1)写出氨气与CuO反应的化学方程式:________________________________________。
(2)为达到上述实验目的,预期的实验现象①________________________;②____________________________________________。
(3)该装置在设计上有一定的缺陷,为确保实验结果的准确性,对该装置的改进措施是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.下列各组物质:
①O2和O3 ②H2、D2、T2 ③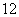 6C和
6C和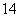 6C
6C
④CH3CH2CH2CH3和(CH3)2CHCH3
⑤乙烷和丁烷
⑥CH3CH2CH2CH(C2H5)CH3和
CH3CH2CH2CH(CH3)C2H5
⑦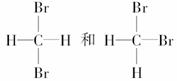
互为同分异构体的是________,互为同位素的是______________________ __________________________________________________,
互为同素异形体的是________,是同一物质的是_______________________ _________________________________________________。
Ⅱ.某化合物A的分子式为C5H11Cl,分析数据表明,分子中含有两个—CH3,两个CH2,一个CH和一个—Cl。
它的可能结构有四种。请写出这四种可能结构简式:
(1)______________,(2)______________,
(3)______________,(4)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
查看答案和解析>>
科目:高中化学 来源: 题型:
固体A的化学式为NH5,它的所有原子的最外电子层结构都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是 ( )
A.1 mol NH5中含有5NA个NH键(NA表示阿伏加德罗常数的数值)
B.NH5中既有共价键又有离子键
C.NH5的电子式为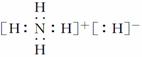
D.NH5与水反应的离子方程式为NH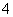 +H-+H2O===NH3·H2O+H2↑
+H-+H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示,下列有关说法不正确的是 ( )。
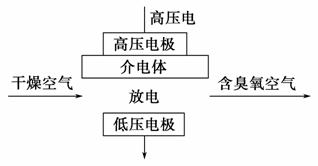
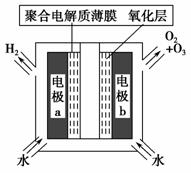
A.高压放电法,反应的原理为3O2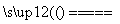 2O3
2O3
B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C.电解时,电极b周围发生的电极反应有3H2O-6e-===O3↑+6H+和
2H2O-4e-===O2↑+4H+
D.电解时,H+由电极a经聚合固体电解质膜流向电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
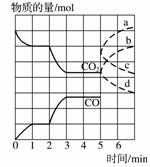
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=__________。
(2)反应进行至2 min时,若升高温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH______0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写字母)。
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是__________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com