
【题目】2016年IUPAC命名117号元素为Ts(中文名“钿”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A. Ts是第七周期第VIIA族元素
B. Ts的同位素原子具有相同的电子数
C. 中子数为176的Ts核素符号是![]()
D. Ts在同族元素中非金属性最弱
科目:高中化学 来源: 题型:
【题目】营养均衡是人体健康的保证. ①在糖类、油脂、蛋白质、维生素这四种营养素中,不能为人的生命活动提供能量的有 . 蛋白质在人体内水解的最终产物是氨基酸,氨基酸的结构可表示为R﹣CH(NH2)﹣X,则X的名称为 .
②某种食品外包装上的配料标签如图所示.配料中具有防腐作用.碳酸氢钠受热易分解,产生的气体可以使食品疏松,碳酸氢钠受热分解的化学方程式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应![]() 可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
(2)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的过程中会产生二氧化硫气体和固体熔渣混合物,用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在Fe3+,检验溶液中是否存在Fe2+的最好的方法是_________________________(用化学反应方程式或离子方程式说明)。
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______________。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(4)用惰性电极电解CuSO4溶液,若只有阳极产生气体,则所得溶液的pH_______(填变大、变小、不变,不考虑溶液体积变化),要使电解质溶液恢复到电解前的状态,可加入____________;若阴阳两极均有气体生成,要使电解质恢复到电解前的状态,可加入__________,当加入该物质1mol即恢复到电解前状态,则电解时电路中转移电子的物质的量为__________摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol·L-1H2SO4溶液中,乙同学将电极放入6mol·L-1的NaOH溶液中,如下图所示。
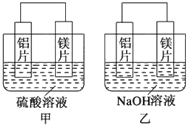
(1)如果甲、乙同学均认为若构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼,则甲会判断出______的活动性更强,而乙会判断出负极的电极反应式为______________。
(2)由此实验,可得到哪些正确的结论?___________(填字母)。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究的对象复杂,反应受条件影响较大,因此应具体问题具体分析
(3)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池的正、负极”的做法_________(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正、负极的可行的实验方案:_______________,(如可靠,此空可不填)。
(4)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如下图所示。该电池反应的化学方程式为:_______________________________。
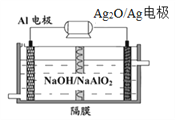
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种糖类物质中,既存在于动物细胞内又存在于植物细胞内的是
A. 淀粉和核糖 B. 葡萄糖、核糖和麦芽糖
C. 核糖、脱氧核糖和葡萄糖 D. 糖原、乳糖、蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米氧化钴在半导体和微电子行业应用广泛,某些金属废料中含有Co元素,从废料(含Co3O4、Al2O3、Li2O、Fe2O3等物质) 中制备高纯度的纳米级钴的氧化物,流程如下
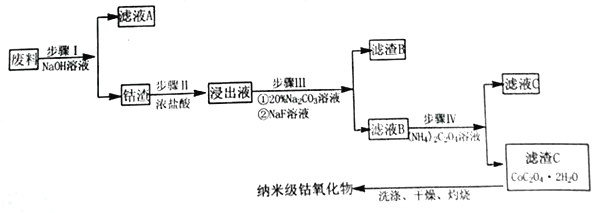
已知:
①LiF 难溶于水,Li2CO3微溶于水;
②钴元素常见的化合价为+2 和+3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中发生的离子反应方程式_______________;
(2)步骤II加浓盐酸的作用是_______________;
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为_______________; 滤渣 B 的主要成分为_________________;
(4)简述如何检验滤液B中是否还有残留的Fe3+:_______________;
(5) 经过反复洗涤、干燥后称重,将质量为3.66gCoC2O4·2H2O进行灼烧,残留固体质量如图所示。
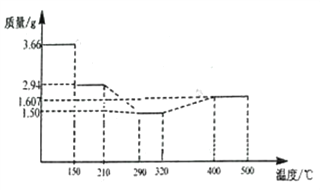
210℃~290℃时若生成两种气体,则发生反应的化学方程式为_______________,400℃~500℃所得固体的化学式为_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
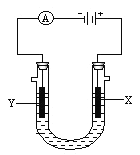
(1)X的电极名称是__________极,发生的电极反应为____________________________;
(2)Y极的电极材料是_________,检验X极产物的方法是_________________________。
(3)某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物,一段时间后又将两极的连接方式纠正过来,发现X极附近出现了白色沉淀,此沉淀是__________(填化学式),其形成原因是_______________________________________,该沉淀在空气中放置,现象是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | H2O | 电石 | KMnO4 | 乙炔具有还原性 | |
D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com