
 (1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是
(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是| 128g |
| 64g/mol |
| ||
| 20% |


科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | E | R | F | |||||
| 三 | A | C | D | H | I | G | ||
| 四 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:
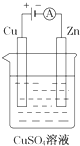
 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空: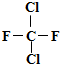 ,下列叙述正确的是:
,下列叙述正确的是:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子晶体中可能含有共价键,一定含有金属元素 |
| B、分子晶体中可能不含共价键 |
| C、非极性分子中一定存在非极性键 |
| D、对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com