
亚氨基锂(Li2NH)是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH.下列有关说法正确的是()
A. Li2NH中N的化合价是﹣1
B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H+的离子半径相等
D. 此法储氢和钢瓶储氢的原理相同
考点: 氧化还原反应.
分析: Li2NH中H元素的化合价是+1,氮元素的化合价为﹣3;LiNH2中氮元素的化合价为﹣3,H元素的化合价是+1;LiH中H元素的化合价是﹣1,可以从化合价变化的角度来判断氧化还原反应的有关概念;离子核外电子层数越多,半径越大;钢瓶储氢是物理过程.
解答: 解:A、Li2NH中氮元素的化合价为﹣3;故A错误;
B、反应物H2中的氢元素的化合价为0价,反应后生成LiNH2中H元素的化合价是+1,LiH中H元素的化合价是﹣1,所以H2既是氧化剂又是还原剂,故B正确;
C、Li+核外有一个电子层,H+核外无电子,离子核外电子层数越多,半径越大,故Li+半径大于H+;故C错误;
D、钢瓶储氢是物理过程,而该方法为化学方法,故D错误.
故选B.
点评: 本题考查氧化还原反应的有关概念,离子半径的大小比较等问题,做题注意从化合价变化的角度判断氧化剂、还原剂的等概念,注意离子半径大小比较的方法,注重基础知识的积累.


科目:高中化学 来源: 题型:
下列各组离子,能在溶液中大量共存的是( )
A. Na+、Mg2+、OH﹣ B. H+、SO42﹣、CO32﹣
C. Cu2+、SO42﹣、Cl﹣ D. Ca2+、Cl﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:
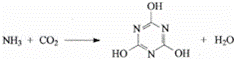
下列有关三聚氰酸的说法正确的是()
A. 分子式为C3H6N303
B. 分子中既含极性键,又含非极性键
C. 属于共价化合物
D. 生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室将NaClO3和Na2SO3按物质的量之比1:2倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为()
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
36.5g HCl溶解在1L水中,所得溶液的密度为ρ g•mL﹣1,质量分数为w,物质的量浓度为cmol•L﹣1,NA表示阿伏加德罗常数,则下列叙述正确的是()
A. 所得溶液的物质的量浓度:c=1mol•L﹣1
B. 所得溶液中含有NA个HCl分子
C. 36.5g HCl气体在标准状况下占有的体积约为22.4L
D. 所得溶液的质量分数:w=36.5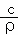
查看答案和解析>>
科目:高中化学 来源: 题型:
某待测溶液(阳离子为Na+)中可能含有SO42﹣、SO32﹣、NO3﹣、C1﹣、Br﹣、S2﹣、CO32﹣、HCO3﹣中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题: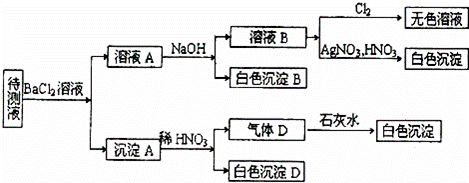
(1)待测液中是否含有SO42﹣、SO32﹣: .
(2)沉淀B的化学式为 ;生成沉淀B的离子方程式为 .
(3)根据以上实验,待测液中肯定没有的离子是 ;肯定存在的离子还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值,下列说法正确的是()
A. 7.8g Na2O2中离子总数为0.4NA
B. 标准状况下,11.2L CCl4中的分子数为0.5NA
C. 常温常压下,48g O2和O3的混合气体中含有的氧原子数为3NA
D. 2.7g金属铝变为铝离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是()
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A和B的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a﹣b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有()
A. 能与水反应 B. 能与氢氧化钠反应
C. 能与硫酸反应 D. 不能与碳酸钠反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com