
A、电路中每转移12 mol电子,最多有 2 mol Cr2O
| ||
| B、阳极反应为Fe-2e-═Fe2+ | ||
| C、电解过程中溶液pH增大 | ||
| D、电解过程中有Fe(OH)3沉淀生成 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、漂白粉的主要成分为Ca(ClO)2 |
| B、蔗糖中加入浓硫酸,搅拌后产生大量的CO2、SO2、SO3 |
| C、SO2、CH3OH、HCHO 都能使酸性高锰酸溶液褪色 |
| D、CaO 是碱性氧化物,CO、SO2、SO3都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x等于6 |
| B、性质稳定,不易脱色 |
| C、易溶于强酸和强碱 |
| D、可用氧化物形式表示BaO?CuO?2SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5.3的NaHSO3溶液:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
| B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、0.1mol?L-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3) |
| D、物质的量浓度相等的NH3?H2O和NH4Cl溶液等体积混合:c(Cl-)=c(NH3?H2O)+c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1869年俄国化学家门捷列夫发现了元素的性质随着原子序数的递增而呈周期性变化的规律 |
| B、1913年丹麦物理学家玻尔提出,原子核外的电子在一系列稳定的轨道上运动会吸收能量和放出能量 |
| C、1923年化学家提出了酸碱质子理论,凡是能给出质子的物质是酸,能接受质子的物质是碱,那么H2O可看作两性物质 |
| D、1940年我国化学专家侯德榜发明了侯氏制碱法,将NH3通往CO2的NaCl饱和溶液中生成溶解度较小的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | HF | HCN | H2C2O4 | |
| 电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=5.9×10-2 | Ka2=6.4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
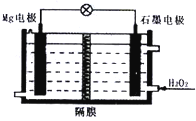 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图,该电池工作时,下列说法不正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图,该电池工作时,下列说法不正确的是( )| A、Mg电极是该电池的负极 |
| B、H2O2在石墨电极上的反应式:H2O2+2e-═2OH- |
| C、若隔膜为阳离子交换膜,则正极区有白色沉淀 |
| D、溶液中Cl-向石墨电极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com