
| 气体物质 | 主要来源 | 对环境的影响 | |
| A | 二氧化碳 | 化石燃料的燃烧 | 酸雨 |
| B | 二氧化硫 | 汽车尾气的排放 | 光化学烟雾 |
| C | 二氧化氮 | 工厂废气的排放 | 温室效应 |
| D | 甲醛 | 各类含酚醛树脂胶的人造板装饰材料 | 室内空气污染 |
| A、A | B、B | C、C | D、D |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| A、锌 镁 |
| B、铁 铝 |
| C、铁 锌 |
| D、镁 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当电池正极消耗mg气体时,电解池阳极同时有mg气体生成 | ||||
| B、电池的正极反应式为:O2+2H2O+4e-=4OH- | ||||
C、电解后
| ||||
| D、电解一段时间,若想恢复Na2CO3原浓度,只需要加入水即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向以物质的量1:1混合的Cu、Fe2O3混合物中加入过量的盐酸 |
| B、以物质的量1:2混合的在(NH4)2SO4与BaCl2溶液 |
| C、以物质的量2:1混合的NaHCO3与Na2O2固体 |
| D、以物质的量2:1混合的MgBr2和氯气反应后的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫、二氧化氮、氮气 |
| B、二氧化硫、二氧化氮、一氧化碳 |
| C、二氧化硫、一氧化碳、二氧化碳 |
| D、二氧化氮、一氧化碳、水蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
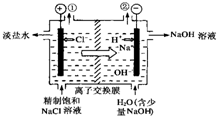 如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )| A、装置中出口①处的物质是氢气,出口②处的物质是氯气 | ||||
| B、该离子交换膜只能让阳离子通过,不能让阴离子通过 | ||||
C、装置中发生反应的离子方程式为:2Cl-+2H2O
| ||||
| D、该装置是将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
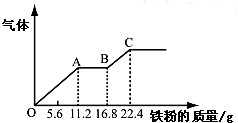 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、原混合酸中NO3-物质的量为0.4 mol |
| B、原混合酸中H2SO4浓度为2.0 mol?L-1 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com