
| A、丁硫醇、甲硫醇与乙硫醇互为同系物 |
| B、沸点不同的丁硫醇有三种 |
| C、从结构上分析了巯基(-SH)上的氢原子比羟基(-OH)上的氢原子难电离 |
| D、与乙醇相似,乙硫醇分子间存在氢键 |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、硫铁矿燃烧前需要粉碎,这样易于向沸腾炉中投料 |
| B、炉气进入接触室之前需要净化、干燥,因为炉气中的杂质易与SO2反应 |
| C、SO2氧化为SO3时需使用催化剂,这样可提高SO2的转化率 |
| D、接触室的反应温度控制在400~500°C,因为在这个温度范围内,反应速率和SO2平衡转化率都比较理想,且催化剂活性也较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
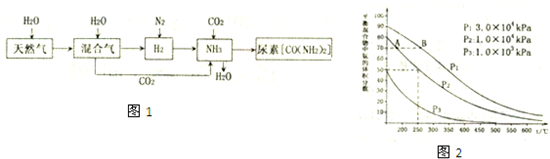
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CCl4萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色 |
| B、石油的裂化、煤的液化和煤的气化都属于化学变化 |
| C、热的苯酚浓溶液放入冷水中冷却,溶液变浑浊,此时发生了化学反应 |
| D、往蛋白质溶液里加入饱和的CuSO4溶液,可提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,若得不到充分利用,变成了制浆造纸工业中的主要污染源之一,不仅造成严重的环境污染,而且也造成资源的重大浪费.木质素的一种单体结构简式如图所示.下列说法正确的是
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,若得不到充分利用,变成了制浆造纸工业中的主要污染源之一,不仅造成严重的环境污染,而且也造成资源的重大浪费.木质素的一种单体结构简式如图所示.下列说法正确的是| A、遇FeCl3溶液呈血红色 |
| B、1mol该物质最多能消耗4mol H2 |
| C、1mol该物质最多能消耗4mol Br2 |
| D、该物质的分子式是C10H12O3,属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
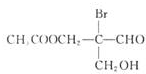 有机物若含手性碳原子(连接四个不同的原子或原子团的碳原子)就具有光学活性,如图物质发生下列反应后生成的有机物仍有光学活性的是( )
有机物若含手性碳原子(连接四个不同的原子或原子团的碳原子)就具有光学活性,如图物质发生下列反应后生成的有机物仍有光学活性的是( )| A、仅③ | B、仅①③ |
| C、仅②④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com