
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 数据模糊 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 数据模糊 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 数据丢失 | 44 | 40 |
分析 (1)根据实验的条件找出相同的、不同的物理量,出现不同的物理量则是要探究的条件,金属的质量相同但状态不同,则探究其接触面积与反应速率的关系;硫酸的体积相同但浓度不同,所以考查了其浓度对反应速率的影响;溶液温度不同,所以探究温度对反应速率的影响;
(2)对比实验的异同,比较反应速率,结合外界条件对反应速率的影响可得出模糊的数据.
解答 解:(1)根据实验的条件找出相同的、不同的物理量,出现不同的物理量则是要探究的条件,金属的质量相同但状态不同,则探究其接触面积与反应速率的关系;硫酸的体积相同但浓度不同,所以考查了其浓度对反应速率的影响;溶液温度不同,所以探究温度对反应速率的影响,将三者影响因素综合考虑,可得出如下结论,金属表面积越大,反应速率越快;硫酸浓度越大,反应速率越快;温度越高,反应速率越快,
故答案为:金属表面积、硫酸溶液浓度、反应温度;
(2)实验1和3相比较,3浓度较大,反应速率较大,所用时间应小于500s,实验3和4相比较,实验3浓度较小,则所用时间应大于200s,则实验3模糊数据应为250,实验5与实验2相比较,金属表面积相等,但实验5浓度较大,反应速率应较大,则实验5时间应小于50,应为25s,实验6与实验4相比较,实验6浓度较大,反应速率较大,所用时间应小于200s,与实验8相比较,浓度较小,所用时间应大于100s,则实验6模糊数据应为125,等量的金属参加反应时,放出的热量相同,则溶液温度升高的数值应和其它实验相同,则实验7的模糊数据应为50,
故答案为:
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | |||||||
| 2 | |||||||
| 3 | 250 | ||||||
| 4 | |||||||
| 5 | 25 | ||||||
| 6 | 125 | ||||||
| 7 | 50 | ||||||
| 8 | |||||||
| 9 | 数据丢失 | ||||||
点评 本题考查化学反应速率的实验探究,本题注意分析表中数据的异同,结合浓度、温度以及固体表面积的大小进行比较,得出结论,题目难度中等.


科目:高中化学 来源: 题型:选择题
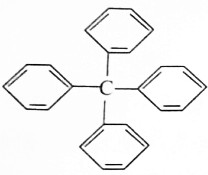 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:| A. | 分子式为C25H20 | |
| B. | 所有碳原子都在同一平面上 | |
| C. | 此物质属于芳香烃类物质 | |
| D. | 该物质中既含有极性键又含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b-c | B. | c-3a-b | C. | 3a-b+c | D. | c-a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
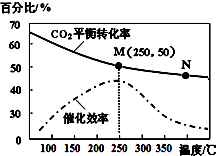 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com