
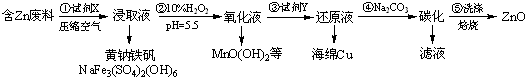
���� ����ͭ�����������ᷴӦ����Fe2+��Zn2+��Mn2+��Mn2+����˫��ˮ��Ӧ����MnO��OH��2����п����ͭ���ӷ�Ӧ����ͭ���ʣ�����п����̼���Ʒ�Ӧ���������ƺ�̼��п��̼��п���ȷֽ���������п��ˮ��
��1������ͭ�����������ᷴӦ����Fe2+��Zn2+��Mn2+��
��2��Mn2+����˫��ˮ��Ӧ����MnO��OH��2����п����ͭ���ӷ�Ӧ����ͭ���ʣ�����п����̼���Ʒ�Ӧ���������ƺ�̼��п��
��3���μ�BaCl2��Һ�����ް�ɫ�������ɣ��������ϴ�Ӹɾ���
��4����ʽ̼��п6.82 g��������պ��ò�������Ϊ����п������Ϊ4.86 g��п������Ϊ3.9g�������������Ƕ�����̼������̼�����2.0 g�����ʵ���Ϊ0.02mol��̼��������ʵ���Ϊ0.02mol�����ݵ���غ�������������ʵ���ΪX=0.08mol���ɼ�ʽ̼��п6.82 g��ȥп��������̼�������������������ʣ�µľ�Ϊˮ��������
��� �⣺��1������ͭ�����������ᷴӦ����Fe2+��Zn2+��Mn2+��Fe2+�ܱ�����ΪFe3+����ȡҺ�εõ�����������˵��XΪNa2SO4��H2SO4�Ļ��Һ��
�ʴ�Ϊ��Fe3+��Cu2+��H2SO4��
��2��Mn2+����˫��ˮ��Ӧ����MnO��OH��2�������ӷ���ʽ��Mn2++H2O2+H2O�TMnO��OH��2��+2H+��п����ͭ���ӷ�Ӧ����ͭ���ʣ�����п����̼���Ʒ�Ӧ���������ƺ�̼��п��Na2SO4����ѭ��ʹ�ã�
�ʴ�Ϊ��Mn2++H2O2+H2O�TMnO��OH��2��+2H+��Zn��Na2SO4��
��3��ȡ���һ��ϴ����Һ�μ�BaCl2��Һ�����ް�ɫ�������ɣ��������ϴ�Ӹɾ���
�ʴ�Ϊ��ȡ���һ��ϴ����Һ1��2mL���Թ��У������еμ�BaCl2��Һ�����ް�ɫ�������ɣ��������ϴ�Ӹɾ���
��4����ʽ̼��п6.82 g��������պ��ò�������Ϊ����п������Ϊ4.86 g�����ʵ���Ϊ$\frac{4.86g}{81g/mol}$=0.06mol��п������Ϊ3.9g�������������Ƕ�����̼������̼�����2.0 g�����ʵ���Ϊ0.02mol��̼��������ʵ���Ϊ0.02mol��
���ݵ���غ�0.06mol��2=0.02mol��2+X
�������������ʵ���ΪX=0.08mol��
�ɼ�ʽ̼��п6.82 g��ȥп��������̼�������������������ʣ�µľ�Ϊˮ��������6.82-3.9-0.02��60-0.08��17=0.36g�����ʵ���Ϊ0.02mol��
�ʼ�ʽ̼��п�����ZnCO3•2Zn��OH��2•H2O ��Zn3��OH��4CO3•H2O��
�ʴ�Ϊ��ZnCO3•2Zn��OH��2•H2O��Zn3��OH��4CO3•H2O��
���� ���⿼���Ʊ�ʵ�鷽������ƣ��漰Ϊ�߿������һ�����ͣ�ÿ��߿��ؿ������ȵ����͡�Ҳ�Ǹ߿��ѵ�֮һ��������Ҫ������������ԭ��Ӧ�����ӷ�Ӧ����ʽ����д����ѧʽ���жϣ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4�� | B�� | 5�� | C�� | 6�� | D�� | 8�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a=b+m-n | B�� | a=b-m+n | C�� | a-m=b+n | D�� | a-m=b-n |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ns2 | B�� | ns2np1 | C�� | ns2np4 | D�� | ns2np5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʴ���� | B�� | ���Ȼ�̼����ȡ�� | ||
| C�� | ������������ˮ���� | D�� | ������������θ���кͼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��š������� | M��Fe�ۣ�/g | V[0.05mol��L-1Na2S2O8]/mL | V[H2O]/mL | �ռ����ݺ͵ó����� | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V����ˮ��/mL | 0.3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  2-�һ����� 2-�һ����� | B�� | CH3CH2CH2CH2OH��1-���� | ||
| C�� |  ����ױ� ����ױ� | D�� |  ��2-��-2-��ϩ ��2-��-2-��ϩ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com