
ЁОЬтФПЁПЯЁЭСдЊЫиАќРЈюжЁЂюЦКЭячЯЕЃЈКЌCeЁЂEu )ЙВ17жждЊЫиЃЌ ЪЧживЊЕФеНТдзЪдДЃЌЮвЪЁЯЁЭСзЪдДЗЧГЃЗсИЛЃЎФГВЪЩЋЕчЪгЛњЯдЪОЦСЩњВњЙ§ГЬжаВњЩњДѓСПЕФЗЯгЋЙтЗлФЉКЌ ( Eu2O3ЁЂSiO2ЁЂFe2O3ЁЂCeO2ЁЂMnO ЕШЮяжЪЃЉЃЎФГПЮЬтзщвдДЫЗлФЉЮЊдСЯЃЌ ЩшМЦШчЯТЙЄвеСїГЬЖдзЪдДНјааЛиЪеЃЌЕУЕННЯЮЊДПОЛЕФCeO2КЭEu2O3 ЃЈбѕЛЏю№ЃЉЃЎ
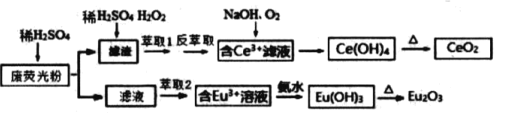
вбжЊЃКCeO2 ВЛШмгкNСђЫсЃЌвВВЛШмгкNaOH ШмвКЃЌEu2O3ПЩШмгкЯЁСђЫс
(1)ЭљТЫдќжаМгЯЁСђЫсКЭH2O2НјааЫсНўЃЌЗДгІЕФРызгЗНГЬЪН____________ ЁЃЮЊСЫЬсИпЫсНўТЪЃЌПЩвдЪЪЕБЬсИпЗДгІЮТЖШЃЌЕЋЮТЖШЦЋИпНўГіТЪЗДЖјЛсМѕаЁЃЌЦфдвђЪЧ________________________________ЁЃ
(2)гаЛњЮяHRФмНЋCe3+ДгЫЎШмвКжанЭШЁГіРДЃЎИУЙ§ГЬПЩБэЪОЮЊЃКCe3+ЃЈЫЎВуЃЉ+3HR(гаЛњВу)![]() CeR3(гаЛњВуЃЉ+3H+(ЫЎВуЃЉЁЃЯђ CeR3(гаЛњВуЃЉжаМгШыЯЁСђЫсНјааЗДнЭШЁФмЛёЕУНЯДПЕФКЌCe3+ЫЎШмвКЃЌДгЦНКтНЧЖШНтЪЭЦфдвђЃК________________________ЁЃ
CeR3(гаЛњВуЃЉ+3H+(ЫЎВуЃЉЁЃЯђ CeR3(гаЛњВуЃЉжаМгШыЯЁСђЫсНјааЗДнЭШЁФмЛёЕУНЯДПЕФКЌCe3+ЫЎШмвКЃЌДгЦНКтНЧЖШНтЪЭЦфдвђЃК________________________ЁЃ
(3)СїГЬжагЩКЌ Ce3+ТЫвКЩњГЩCe(OH)4ЕФРызгЗНГЬЪН____________________ЁЃ
(4)ШЁЩЯЪіСїГЬжаЕУЕНЕФCe(OH)4 ВњЦЗ 0.52 g, МгСђЫсШмНтКѓЃЌгУХЈЖШЮЊ 0.1000molL-1FeSO4БъзМШмвКЕЮЖЈжСжеЕуЪБЃЌюцБЛЛЙдЮЊCe3+ , ЯћКФ 24.00 mL БъзМШмвКЁЃИУВњЦЗжа Ce(OH)4ЕФжЪСПЗжЪ§ЮЊ___________ЁЃ
(5)вбжЊКЌ Ce3+ШмвКвВПЩвдЯШМгМюЕї pHКѓдйЭЈШыбѕЦјбѕЛЏПЩЕУЕНCe(OH)4ЁЃ298K ЪБ,Ksp[Ce(OH)3]=5ЁС10-20ЃЌШєШмвКжаc(Ce3+)=0.05molL-1, МгМюЕїНкpH ЕН_____ЪБCe3+ПЊЪМГСЕэЃЈКіТдМгМюЙ§ГЬжаШмвКЬхЛ§БфЛЏЃЉЃЎ
(6)нЭШЁМСЖдН№ЪєРызгЕФнЭШЁТЪгы pHЕФЙиЯЕШчЭМЫљЪОЃЎСїГЬжаЮЊСЫгУнЭШЁМСГ§ШЅН№ЪєдгжЪРызгЃЌНјаанЭШЁ2 зюЪЪвЫЕФpH ЪЧ_______ЃЈЬюбЁЯюађКХЃЉЃЎЦфдвђЪЧ _____ЁЃ
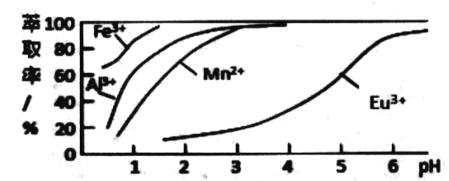
A. 2.0 зѓгв B . 3.0 зѓгв C. 5.0 зѓгв
ЁОД№АИЁП2CeO2+H2O2+6H+=2Ce3++O2Ёќ+4H2O ЮТЖШЩ§ИпЃЌH2O2ЪмШШвзЗжНтЃЌдьГЩНўГіТЪЦЋЕЭЃЛ МгШыЯЁСђЫсЪБЃЌcЃЈH+ЃЉдіДѓЃЌЦНКтЯђаЮГЩCe3+ЕФЗНЯђвЦЖЏЃЌ 4Ce3++O2+12OH-+2H2O=4Ce(OH)4 96% 8 B ЪЙFe3+ЁЂMn2+ЭъШЋГ§ШЅЃЌВЂЗРжЙEu3+БЛнЭШЁЕМжТЫ№ЪЇ
ЁОНтЮіЁП
ЗЯгЋЙтЗлФЉКЌ ( Eu2O3ЁЂSiO2ЁЂFe2O3ЁЂCeO2ЁЂMnO ЕШЮяжЪЃЉЃЌМгШыСђЫсЃЌТЫвККЌгаEu3+ЁЂFe3+ЁЂMn2+ЕШЃЌОнЭШЁЃЌПЩГ§ШЅFe3+ЁЂMn2+ЕШЃЌМгШыАБЫЎЃЌПЩЩњГЩEuЃЈOHЃЉ3ЃЌМгШШЗжНтПЩЩњГЩEu2O3ЃЛТЫдќжаКЌгаCeO2 ЁЂSiO2ЃЌМгШыЯЁСђЫсКЭЙ§бѕЛЏЧтЃЌОнЭШЁЁЂЗДнЭШЁЃЌПЩЕУЕНКЌгаCe3+ЕФШмвКЃЌМгШыЧтбѕЛЏФЦВЂЭЈШыбѕЦјЃЌПЩЩњГЩCeЃЈOHЃЉ4ЃЌМгШШПЩЩњГЩCeO2ЁЃ
ЃЈ1ЃЉдкЫсНўЪБЗЂЩњЕФРызгЗДгІЮЊ2CeO2+H2O2+6H+=2Ce3++O2Ёќ+4H2OЃЌH2O2ЪмШШвзЗжНтЃЌЮЊЗРжЙЦфЗжНтЃЌдђЮТЖШВЛвЫЬЋИпЃЌЙЪД№АИЮЊЃК2CeO2+H2O2+6H+=2Ce3++O2Ёќ+4H2OЃЛЮТЖШЩ§ИпЃЌH2O2ЪмШШвзЗжНтЃЌдьГЩНўГіТЪЦЋЕЭЃЛ
ЃЈ2ЃЉИљОнЦНКтCe3+ЃЈЫЎВуЃЉ+3HR(гаЛњВу)![]() CeR3(гаЛњВуЃЉ+3H+(ЫЎВуЃЉЃЌЯђ CeR3(гаЛњВуЃЉжаМгШыЯЁСђЫсЪБЃЌcЃЈH+ЃЉдіДѓЃЌЦНКтЯђаЮГЩCe3+ЕФЗНЯђвЦЖЏЃЌдђCe3+ДгЫЎШмвКжаБЛнЭШЁГіРДЃЌЙЪД№АИЮЊЃКМгШыЯЁСђЫсЪБЃЌcЃЈH+ЃЉдіДѓЃЌЦНКтЯђаЮГЩCe3+ЕФЗНЯђвЦЖЏЃЛ
CeR3(гаЛњВуЃЉ+3H+(ЫЎВуЃЉЃЌЯђ CeR3(гаЛњВуЃЉжаМгШыЯЁСђЫсЪБЃЌcЃЈH+ЃЉдіДѓЃЌЦНКтЯђаЮГЩCe3+ЕФЗНЯђвЦЖЏЃЌдђCe3+ДгЫЎШмвКжаБЛнЭШЁГіРДЃЌЙЪД№АИЮЊЃКМгШыЯЁСђЫсЪБЃЌcЃЈH+ЃЉдіДѓЃЌЦНКтЯђаЮГЩCe3+ЕФЗНЯђвЦЖЏЃЛ
ЃЈ3ЃЉСїГЬжаCe3+гыбѕЦјЁЂЧтбѕЛЏФЦЗДгІЩњГЩ Ce(OH)4ЃЌРызгЗНГЬЪНЮЊ4Ce3++O2+12OH-+2H2O=4Ce(OH)4ЃЌЙЪД№АИЮЊЃК4Ce3++O2+12OH-+2H2O=4Ce(OH)4ЃЛ
ЃЈ4ЃЉCe(OH)4МгСђЫсШмНтКѓЃЌБЛFeSO4ЛЙдЮЊCe3+ ,дђгаCe(OH)4~ Ce3+~ FeSO4ЃЌдђn[Ce(OH)4]=0.1ЁС24ЁС10-3mol=2.4ЁС10-3molЃЌm[Ce(OH)4]=2.4ЁС10-3molЁС208g/mol=0.4992gЃЌИУВњЦЗЕФДПЖШЮЊЃК![]() ЃЌЙЪД№АИЮЊЃК96%ЃЛ
ЃЌЙЪД№АИЮЊЃК96%ЃЛ
ЃЈ5ЃЉ298KЪБЃЌKsp[Ce(OH)3]=5ЁС10-20ЃЌШєШмвКжаc(Ce3+)=0.05molL-1, Ce3+ПЊЪМГСЕэЃЌдђcЃЈOH-ЃЉ=![]() ЃЌдђpH=8ЃЌЙЪД№АИЮЊЃК8ЃЛ
ЃЌдђpH=8ЃЌЙЪД№АИЮЊЃК8ЃЛ
ЃЈ6ЃЉШмвКжаДцдкEu3+ЁЂMn2+Н№ЪєРызгЃЌгЩнЭШЁМСЖдН№ЪєРызгЕФнЭШЁТЪгы pHЕФЙиЯЕЭМПЩжЊЃЌЕїНкpHдк3.0зѓгвЃЌПЩЪЙFe3+ЁЂMn2+ЭъШЋГ§ШЅЃЌВЂЗРжЙEu3+БЛнЭШЁЕМжТЫ№ЪЇЃЌЙЪД№АИЮЊЃКBЃЛЪЙFe3+ЁЂMn2+ЭъШЋГ§ШЅЃЌВЂЗРжЙEu3+БЛнЭШЁЕМжТЫ№ЪЇЁЃ


 ЛЦИдПЮЬУзївЕБОЯЕСаД№АИ
ЛЦИдПЮЬУзївЕБОЯЕСаД№АИ ЕЅдЊМгЦкФЉИДЯАЯШЗцДѓПМОэЯЕСаД№АИ
ЕЅдЊМгЦкФЉИДЯАЯШЗцДѓПМОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЮяжЪжЎМфЕФЛЏбЇЗДгІЃЌЗДгІВњЮявЛЖЈЮЊДПОЛЮяЕФЪЧЃЈ ЃЉ
A.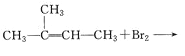 B.
B.![]() C.
C.![]() D.
D.![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГгаЛњЮяAЕФНсЙЙЮЊ ЃЌ ЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
ЃЌ ЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
A. 1 mol AФмИњ2 mol NaOHШмвКЗДгІ
B. ФмЗЂЩњМгОлЗДгІ
C. ВЛФмЗЂЩњЗжзгФкѕЅЛЏЗДгІ
D. AЗжзгжаЫљгадзгдкЭЌвЛЦНУцЩЯ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдЕчГидРэЕФЗЂЯжЪЧжќФмКЭЙЉФмММЪѕЕФОоДѓНјВНЁЃЭМЫљЪОдЕчГиЕФЫЕЗЈе§ШЗЕФЪЧ
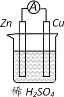
A.ЕчзгОаПЦЌСїЯђЭЦЌ
B.CuЮЊИКМЋЃЌZnЮЊе§МЋ
C.ИУзАжУФмНЋЕчФмзЊЛЏЮЊЛЏбЇФм
D.аПЦЌЩЯЗЂЩњЕФЗДгІЮЊ 2H++2e-=H2Ёќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаНтЪЭЪТЪЕЕФЗНГЬЪНЃЌВЛе§ШЗЕФЪЧ
A.ЬњЗлгыСђЗлЛьКЯМгШШЗДгІЃКFe + S![]() FeS
FeS
B.КьШШЕФЭЫПгыСђеєЦјЛЏКЯЃКCu ЃЋ S ![]() CuS
CuS
C.УОЬѕдкЕЊЦјжаШМЩеЃК3MgЃЋN2 ![]() Mg3N2
Mg3N2
D.КьШШЕФФОЬПгыХЈСђЫсЗДгІЃКC+2H2SO4(ХЈ)![]() CO2Ёќ+2SO2Ёќ+2H2O
CO2Ёќ+2SO2Ёќ+2H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПягФјПЩГфЕчЕчГиЕФГфЁЂЗХЕчЗДгІАДЯТЪННјааЃКCdЃЋ2NiO(OH)ЃЋ2H2O![]() Cd(OH)2ЃЋ2Ni(OH)2ЃЌгЩДЫХаЖЯЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
Cd(OH)2ЃЋ2Ni(OH)2ЃЌгЩДЫХаЖЯЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
A. ЗХЕчЪБЃЌNiO(OH)зїе§МЋ
B. ЗХЕчЪБЃЌCdЗЂЩњЛЙдЗДгІ
C. ЕчНтжЪШмвКЮЊМюадШмвК
D. ГфЕчЪБЃЌбєМЋЗДгІЮЊNi(OH)2ЃЋOHЃЃeЃ== NiO(OH)ЃЋH2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ25 mL 0.1 molЁЄL-1NaOHШмвКжаж№ЕЮЕЮМг0.2 molЁЄL-1ЕФHN3ЃЈЕўЕЊЫсЃЉШмвКЃЌpHЕФБфЛЏЧњЯпШчЭМЫљЪОЃЈШмвКЛьКЯЪБЬхЛ§ЕФБфЛЏКіТдВЛМЦЃЌЕўЕЊЫсЕФKa=10-4.7ЃЉЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. 0.1 molЁЄL-1 NaN3ШмвКpHдМЮЊ8.85
B. дкBЕуЃЌРызгХЈЖШДѓаЁЮЊc(OHЃ)>c(H+)>c (Na+)>c(N3Ѓ)
C. дкCЕуЃЌЕЮМгЕФV(HN3)<12.5 mL
D. дкDЕуЃЌc(Na+)=2c(HN3)+2 c(N3Ѓ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЬМЫсФЦЃЈДПЖШдМЮЊ98%ЃЉжаГЃКЌгаCa2+ЁЂMg2+ЁЂFe3+ЁЂCl-КЭS![]() ЕШдгжЪ,ЮЊСЫЬсДПЙЄвЕЬМЫсФЦ,ВЂЛёЕУЪдМСМЖЬМЫсФЦЕФМђвЊЙЄвеСїГЬШчЭМ:
ЕШдгжЪ,ЮЊСЫЬсДПЙЄвЕЬМЫсФЦ,ВЂЛёЕУЪдМСМЖЬМЫсФЦЕФМђвЊЙЄвеСїГЬШчЭМ:

вбжЊ:ЬМЫсФЦЕФБЅКЭШмвКдкВЛЭЌЮТЖШЯТЮіГіЕФШмжЪШчЭМЫљЪО:
![]()
ЃЈ1ЃЉШШЕФNa2CO3ШмвКгаНЯЧПЕФШЅгЭЮлФмСІ,ЦфдвђЪЧЃЈгУРызгЗНГЬЪНМАБивЊЕФЮФзжМгвдНтЪЭ______ЁЃ
ЃЈ2ЃЉЁАГУШШЙ§ТЫЁБЪБЕФЮТЖШгІПижЦдк______ЁЃ
ЃЈ3ЃЉвбжЊ:Na2CO3ЁЄ10H2OЃЈsЃЉ=Na2CO3ЃЈsЃЉ+10H2OЃЈgЃЉЁЁІЄH=+532.36 kJЁЄ mol-1
Na2CO3ЁЄ10H2OЃЈsЃЉ=Na2CO3ЁЄH2OЃЈsЃЉ+9H2OЃЈgЃЉЁЁІЄH=+473.63kJЁЄ mol-1
аДГіNa2CO3ЁЄH2OЭбЫЎЗДгІЕФШШЛЏбЇЗНГЬЪН:_____________ЁЃ
ЃЈ4ЃЉгаШЫДгЁАТЬЩЋЛЏбЇЁБНЧЖШЩшЯыНЋЁАФИвКЁБбиСїГЬЭМжаащЯпЫљЪОНјаабЛЗЪЙгУ,ЧыФуЗжЮіЪЕМЪЩњВњжаЪЧЗёПЩаа:______,ЦфРэгЩЪЧ____________________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДяЯВЪЧГЃгУЕФжаКЭЮИЫсЕФвЉЮяЃЌЦфгааЇГЩЗжЪЧКЌНсОЇЫЎЕФТСУОМюЪНбЮЁЃШЁИУМюЪНбЮ6.02gЃЌЯђЦфжаж№ЕЮМгШы4.00molЁЄL-1ЕФбЮЫсЃЌЕБМгШыбЮЫс42.5mLЪБПЊЪМВњЩњCO2ЃЌМгШыбЮЫсжС45.0mLЪБЧЁКУЗДгІЭъШЋЁЃ
ЃЈ1ЃЉМЦЫуИУМюЪНбЮбљЦЗжаЬМЫсИљгыЧтбѕИљЕФЮяжЪЕФСПжЎБШЃК__ЁЃ
ЃЈ2ЃЉШєДяЯВжаУОЁЂТСдЊЫиЕФЮяжЪЕФСПжЎБШЮЊ3ЃК1ЃЌдђЧтдЊЫиЕФжЪСПЗжЪ§ЮЊ__ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com