
废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.石墨 B.二氧化锰C.锌 D.汞
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列叙述正确的是( )。
A.42 g C3H6中含有的共用电子对数目为8 NA
B.电解饱和食盐水时,当0.1 mol NaCl反应时,转移的电子数为0.1 NA
C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA
D.1 L 0.01 mol·L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)
D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O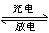 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:填空题
(6 分)二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
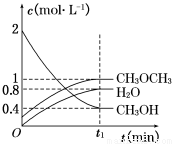
(1)该条件下反应平衡常数表达式K=________。在T1℃时,反应的平衡常数为________;
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1,c(H2O)=0.6 mol·L-1、c(CH3OCH3)=1.2 mol·L-1,此时正、逆反应速率的大小:v(正)________v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
下列事实不能说明一元酸HA为弱酸的是( )
A.常温下0.1 mol·L-1的HA溶液pH为5
B.常温下NaA溶液的pH>7
C.HA溶液中存在H+、OH-、A-、HA
D.HA溶液能与大理石反应
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:填空题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
则该醋酸溶液的准确浓度为__________(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
____________________________________________________
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度________(填“增大”、“减小”或“不变”)。
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:____________________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:填空题
天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料时的相对投资费用和能量消耗的数据。
原料 | 天然气 | 重油 | 煤 |
相对投资费用 | 1.0 | 1.5 | 2.0 |
能量消耗/J·t-1 | 28×109 | 38×109 | 48×109 |
请回答下列问题。
(1)依据上表信息,你认为采用________为原料最好。
(2)请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
____________________________________________
(3)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g);ΔH=-394 kJ·mol-1①
2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1②
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1③
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com