
 .下列有关M的说法正确的是( )
.下列有关M的说法正确的是( )| A. | 1mol M与烧碱溶液反应时最多消耗2molNaOH | |
| B. | M不能使酸性KMnO4溶液褪色,但能发生取代反应 | |
| C. | M的分子式为C8H14O3 | |
| D. | M可通过加聚反应生成高分子化合物 |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
| 时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
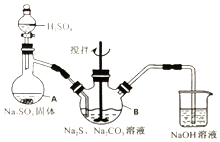 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
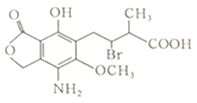
| A. | 分子式为C14H25O6NBr | |
| B. | 该分子中含有两个手性碳原子 | |
| C. | 不能使酸性高锰酸钾溶液褪色 | |
| D. | Q在一定条件下与氢氧化钠溶液反应,1molQ最多消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  所示装且制取Fe(OH)2 | |
| B. | 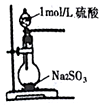 所示装置制取SO2 | |
| C. | 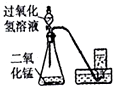 所示装置制取O2 | |
| D. | 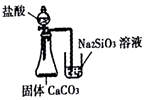 所示装置比较Cl、C、Si的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y>W | |
| B. | 上述四种元素的单质中只有2种能导电 | |
| C. | X与Z两者的最高价氧化物的组成和结构相似 | |
| D. | 在加热条件下,Y的单质可溶于W的最高价含氧酸的浓溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
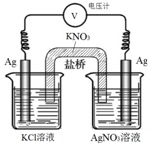 一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 右池中的银电极作负极 | B. | 总反应为Ag++Cl-=AgCl | ||
| C. | 正极反应为Ag-e-=Ag+ | D. | 盐桥中的NO3-向右池方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com