
【题目】下列反应中水既不是氧化剂,又不是还原剂的氧化还原反应是( )
A.SO3+H2O=H2SO4
B.2Na2O2+2H2O=4NaOH+O2↑
C.2F2+2H2O=4HF+O2
D.NaH+H2O=NaOH+H2↑
科目:高中化学 来源: 题型:
【题目】钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为_________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O)2] 3+的几何异构体种数有(不考虑光学异构)___________种。
(3)金属钴是由______键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,Co2+和Fe2+的离子半径分别为74.5pm和78pm,则熔点CoO______FeO。
(4)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿佛加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。

关于此反应的说法不正确的是
A. 反应物总能量一定低于生成物总能量 B. 一定属于可逆反应
C. 一定有非极性共价键断裂 D. 一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有Na+、K+、Fe3+、Mg2+、Cl-、I-、CO32-、SO42-,限用试剂有:盐酸、硫酸、硝酸钡溶液、硝酸银溶液。设计如下实验步骤,并记录相关现象:
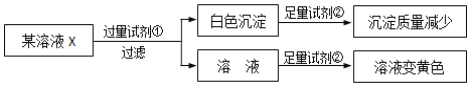
(已知,NO3-在酸性条件下具有强氧化性)
下列叙述不正确的是
A. 试剂①为硝酸钡
B. 试剂②一定为盐酸
C. 该溶被中一定有I-、CO32-、SO42-;Na+、K+至少含有一种
D. 通过在黄色溶液中加入硝酸银可以检验原溶液中是否存在C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是人体重要的营养物质,是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G的蒸气密度是E蒸气密度的2倍。它们之间的转化关系如图:

(1)向试管中加入2mL10%氢氧化钠溶液,滴加4-5滴5%硫酸铜溶液,振荡后加入2mL10%的E的溶液,加热,可观察到的现象是___________。
(2)写出C和F在浓H2SO4作用下生成G的化学方程式________,该反应的类型是______。
(3)已知D和F在催化剂作用下反应也能生成G,写出该反应的化学方程式______。
(4)下列说法不正确的是________。
a.要确定A已发生部分水解,先将水解液中和成碱性,再用银氨溶液和碘水分别检验
b.有机物B、C、D和G均能使酸性KMnO4溶液褪色
c.将足量的D通入溴水中,可以观察到溴水褪色,溶液分层
d.某烃X的相对分子质量是D、H之和,则X能与溴水发生加成反应
(5)写出比G少一个碳原子的同系物的可能结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学进行实验研究FeCl3溶液和Na2S溶液的反应。
【实验一】

已知:FeS、Fe2S3均为黑色固体,均能溶于盐酸。H2S气体有臭鸡蛋气味。
同学们对黑色沉淀的成分提出两种假设:
ⅰ.Fe3+与S2反应直接生成沉淀Fe2S3。ⅱ.Fe3+被S2还原,生成沉淀FeS和S。
甲同学进行如下实验:
操作 | 现象 |
取少量FeS固体,加入稀盐酸 | 固体溶解,有臭鸡蛋气味气体生成 |
取少量Fe2S3固体,加入稀盐酸 | 固体溶解,出现淡黄色浑浊,有臭鸡蛋气味气体生成 |
根据上述实验现象和资料,甲得出结论:黑色沉淀是Fe2S3。
(1)0.1 mol·L 1 Na2S溶液的pH为12.5。用离子方程式表示其显碱性的原因:_______。
(2)乙认为甲的结论不严谨,理由是________。
(3)进一步研究证实,黑色沉淀的主要成分是Fe2S3。Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是________。
【实验二】
步骤 | 操作 | 现象 |
I |
| 开始时,局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失,同时溶液中产生淡黄色浑浊和臭鸡蛋气味的气体 |
II | 继续滴加Na2S溶液 | 一段时间后,产生大量的黑色沉淀,振荡,沉淀不消失 |
(4)进一步实验证实,步骤 I 中局部产生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应。步骤 I 中黑色沉淀溶解的反应的离子方程式是________。
(5)根据以上研究,FeCl3溶液和Na2S溶液反应的产物与________相关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定条件下断裂或形成某些化学键的能量关系如下表:
断裂或形成的化学键 | 能量数据 |
断裂1 mol H2分子中的化学键 | 吸收能量436 kJ |
断裂1 mol Cl2分子中的化学键 | 吸收能量243 kJ |
形成1 mol HCl分子中的化学键 | 释放能量431 kJ |
对于反应:H2(g)+Cl2(g)===2HCl(g),下列说法正确的是
A. 该反应的反应热ΔH>0
B. 生成1 mol HCl时反应放热431 kJ
C. 氢气分子中的化学键比氯气分子中的化学键更牢固
D. 相同条件下,氢气分子具有的能量高于氯气分子具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3- (aq)。某I2、KI混合溶液中I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
I3- (aq)。某I2、KI混合溶液中I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是

A. 反应I2(aq)+I-(aq) ![]() I3- (aq)的ΔH>0
I3- (aq)的ΔH>0
B. 若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2
C. 若反应进行到状态D时,一定有v(正) > v(逆)
D. 状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 用惰性电极电解KOH溶液,若阳极产生5.6L气体,则电路中通过0.5NA电子
B. 常温常压下.4.6gNO2气体所含的分子数为0.1NA
C. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为NA
D. 100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com