
����Ŀ����(Fe)��ͭ(Cu)����(Ag)�dz����Ľ���Ԫ�أ����ǵĵ��ʼ��仯�������������й㷺Ӧ�á�
(1)Ag �� Cu ��ͬһ�壬�� Ag �����ڱ���________ (����s������p������d������ds��)����[Ag(NH3)2]+�� Ag+�յ� 5s ����� 5p �����sp �ӻ��ɼ�����������ӵĿռ乹����________��
(2)��̬ Cu+�ļ����Ų�ʽΪ________��
(3)������ Fe �� Cu �IJ��ֵ��������ݣ������ I2(Cu)���� I2(Fe)����Ҫԭ��________��
Ԫ�� | Fe | Cu |
��һ������ I1/kJ��mol��1 | 759 | 746 |
�ڶ������� I2/kJ��mol��1 | 1561 | 1958 |
(4)�����軯����ʳ���г��õĿ�������仯ѧʽΪ K4[Fe(CN)6]��
��CN-�ĵ���ʽ��________��1mol ���������к��� ����ĿΪ________��
�ڸ�������д��ڵ�������������________ (����ĸ)��
A.������ B.���Ӽ� C.���ۼ� D.��λ�� E.��� F.���»���
(5)������������ľ����ṹ��ͼ��ʾ����֪��
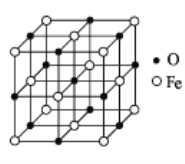
��������������ܶ�Ϊ ��gcm��3��NA���������ӵ�������ֵ���ڸþ����У��� Fe2+�����ҵȾ���� Fe2+��ĿΪ________��Fe2+��O2����̺˼��Ϊ________pm��
���𰸡�ds ֱ���� [Ar]3d10 ʧȥ�ڶ�������ʱ��Cu ʧȥ����ȫ���� 3d10 ���ӣ�Fe ʧȥ���� 4s1 ���� ![]() 12NA BCD 12
12NA BCD 12 ![]() ��1010
��1010
��������
(1)Ag�ڵ������ڵڢ�B�壻�����⣺[Ag(NH3)2]+��Ag+��sp�ӻ��ɼ���
(2)ͭ��29��Ԫ�أ�����Cu����̬��������Ų�ʽ��
(3)���ݵ����Ų�������
(4)��CN-��N2�ǵȵ����壬�ṹ���ƣ����ݵ�������ʽ��д��CN-��Fe2+����λ����ϣ���6����λ������������������6��CN-�и���һ��������
�ڸ���K4 [Fe(CN)6]����ʽ������
(5)���ݾ�����Fe2+Ϊ������������Fe2+�����ҵȾ����Fe2+��ĿΪ12���������������������������Ӻ˼���2����
(1)Ag�ڵ������ڵڢ�B�壬����ds���������⣺[Ag(NH3)2]+��Ag+��sp�ӻ��ɼ���Ӧ����ֱ���Σ��ʴ�Ϊ��ds��ֱ���Σ�
(2)ͭ��29��Ԫ�أ�Cu����̬��������Ų�ʽΪ[Ar]3d10���ʴ�Ϊ��[Ar]3d10��
(3)Cu+�ļ۵����Ų�ʽΪ3d10��Fe+�ļ۵����Ų�ʽΪ3d64s1��Cu+��ʧȥ����3d10�ϵĵ��ӣ���Fe+ʧȥ����4s1�ĵ��ӣ�����ԭ�Ӻ�����Ӵ���ȫ�������������ȫ��ʱ���ȶ���״̬����Ȼ3d10����ȫ���������ȶ�������ʧȥ�ڶ�������ʱ��Cu ʧȥ����ȫ���� 3d10 ���ӣ���Ҫ�������ߣ���Fe ʧȥ����4s1 ���ӣ����������ͣ��ʴ�Ϊ��ʧȥ�ڶ�������ʱ��Cu ʧȥ����ȫ���� 3d10 ���ӣ�Fe ʧȥ���� 4s1 ���ӣ�
(4)��CN-��N2�ǵȵ����壬�ṹ���ƣ����ݵ�������ʽ��д��������ӵ���ʽΪ![]() ��CN-��Fe2+����λ����ϣ���6����λ������������������6��CN-�и���һ��������1���������к��е���������12������1mol���������к��� 12 NA���������ʴ�Ϊ��
��CN-��Fe2+����λ����ϣ���6����λ������������������6��CN-�и���һ��������1���������к��е���������12������1mol���������к��� 12 NA���������ʴ�Ϊ��![]() ��12NA��
��12NA��
��K4 [Fe(CN)6]�����ӻ�����������Ӽ���������K+��������֮�������Ӽ���ϣ�Fe2+��CN-����λ����ϣ�CN-�е�����ԭ���Լ��Թ��ۼ���ϣ� �ʴ�Ϊ��BCD��
(5)���ݾ�����Fe2+Ϊ������������Fe2+���ڵĵȾ����Fe2+��12����������̯�����������к�Fe2+��8![]() +6
+6![]() =4������O2-��12
=4������O2-��12![]() +1=4��������Ļ�ѧʽΪFeO��1molFeO������Ϊ72g��1mol��������Ϊ
+1=4��������Ļ�ѧʽΪFeO��1molFeO������Ϊ72g��1mol��������Ϊ![]() cm3�����������Ϊ
cm3�����������Ϊ![]() cm3
cm3![]() NA
NA![]() 4=
4=![]() cm3�������ı߳�Ϊ
cm3�������ı߳�Ϊ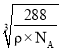 cm��Fe2+��O2-��̺˼��Ϊ
cm��Fe2+��O2-��̺˼��Ϊ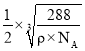 cm=
cm=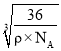 cm=
cm=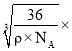 1010pm���ʴ�Ϊ��12��
1010pm���ʴ�Ϊ��12��![]() ��1010��
��1010��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������98%��Ũ����(g��1.84g��cm��3)���Ƴ�Ũ��Ϊ0.5mol��L��1��ϡ����500ml��
(1)ѡ�õ���Ҫ�����У�
��__________����__________����__________����____________����____________��
(2)�뽫���и�����������ȷ��������ں����ϡ�
A������Ͳ��ȡŨH2SO4 |
B�������ߵ�ҡ�� |
C���ý�ͷ�ιܼ�����ˮ���̶��� |
D��ϴ���������� |
E��ϡ��ŨH2SO4
F������Һת������ƿ
�������ȷ��˳������Ϊ______________________��
(3)��Ҫ�ش��������⣺
������Ũ��������Ϊ____________mL��
�����ʵ������15mL��20mL��50mL����ͲӦѡ��____________mL����Ͳ��ã���ȡʱ������Ͳ���ɾ���ˮϴ����ֱ����ȡ��ʹŨ��__________(��ƫ��������ƫ����������Ӱ����)
����Ũ�������ձ��ڱ�����ע��ʢˮ���ձ��У����ò��������Ͻ����Ŀ����____________���������������Һ�彦�������ʹŨ��ƫ____________��
����ת������ƿǰ�ձ���Һ��Ӧ____________�������ʹŨ��ƫ____________����ϴ���ձ��Ͳ�����2��3�Σ�ϴ��ҺҲҪת������ƿ�������ʹŨ��____________��
������ʱ����ʹ��Һ��Һ����̶������У������ӻ�ʹŨ��____________��������ʹŨ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA�ǰ����ӵ�������ֵ������˵����ȷ����
A.�ܱ������У�2 mol NO �� 1 mol O2 ��Ӧ���������Ϊ 2NA
B.��״���£�7.8 g ��Ȳ�ͱ��Ļ�����к� C��H ����ĿΪ 0.6NA
C.�� 1 mol NH3 ͨ������ˮ�У�NH3��H2O��NH4+������Ŀ֮��Ϊ NA
D.1 L 0.1 mol��L1 FeCl3 ��Һ�к� Fe3+��ĿΪ 0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��W���ֶ�����Ԫ�ء�Xԭ�ӵ�����������Ӳ�����ͬ��Wԭ�Ӻ����������Mԭ��������������2����Y��Z��M��W�����ڱ��е����λ����ͼ��ʾ������˵������ȷ����
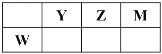
A. ԭ�Ӱ뾶��W>Y>Z>M>X
B. ���ȶ��ԣ�XM>X2Z
C. ����X��Y��Z����Ԫ���γɵĻ������в����ܺ����Ӽ�
D. WM4������ÿ��ԭ������������8���ӽṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˵�����ˮ����ʴ���������ڴ����ϰ�װ���͵�п�飬����ԭ��ط�Ӧ��2Zn+2H2O+O2 = 2Zn(OH)2������˵����ȷ����
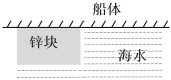
A. п����Ϊԭ��صĸ�����������ԭ��Ӧ������ʴ
B. ��ˮ�еĵ������NaCl���˵��������
C. �����ĵ缫��ӦʽΪ��Zn - 2e����Zn2+
D. ʵ��Ӧ���У�����п�鸲�����壬��ȫ������ˮ�Է�ֹ��������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
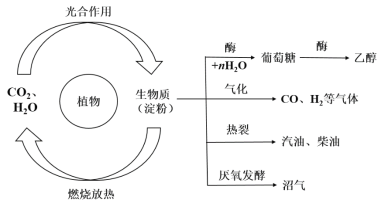
����Ŀ��ֲ�����ͨ��������������ںϳ��л������Ϊ�����ʣ��Ե���Ϊ�����������й�����Ӧ��ǰ������֪�����ʵ���Ҫת��;������Ҫ������ͼ��ʾ��
��ش�
��1��ũ��ȼ���������ܵķ�Ӧ����Ϊ���е�______��
A�����ȷ�Ӧ B�����ȷ�Ӧ C��������ԭ��Ӧ D����������ԭ��Ӧ
��2��д�������ǵĻ�ѧʽ________________����ͼ�������ǵõ��Ҵ��ķ�Ӧ����һ���������ĽṹʽΪ__________________��
��3������˵������ȷ����______��
A���������е�����������������̫����
B���������������������������������ڻ�ѧ�ܣ���������������
C����ͼ�������ʵ�����ת����Ϊ��ѧ��Ӧ
D��ֱ��ȼ����������һ�ָ�Ч������Դ�ķ�ʽ
��4����֪18 g�������ǹ��屻������ȫ�������������������ʱ�ų�����254 kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������������Ʊ���Ѫ����ij�о�С���Ʊ��� FeCO3������ FeCO3 �����ʺ�Ӧ�ý�����̽����
��֪����FeCO3 �ǰ�ɫ���壬������ˮ��Fe2++6SCN-Fe(SCN)64-(��ɫ)
��.FeCO3 ����ȡ(�г�װ����)
ʵ��i
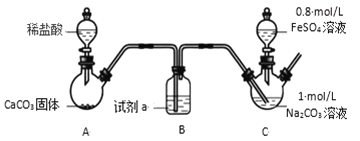
װ�� C �У��� Na2CO3 ��Һ(pH��11.9)ͨ��һ��ʱ�� CO2 ���� pH Ϊ 7���μ�һ���� FeSO4��Һ��������ɫ���������ˡ�ϴ�ӡ�����õ� FeCO3 ���塣
(1)�Լ� a ��________��
(2)�� Na2CO3 ��Һͨ�� CO2 ��Ŀ����________��
(3)C װ������ȡ FeCO3 �����ӷ���ʽΪ________��
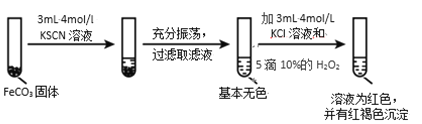
��.FeCO3 ������̽��
ʵ��ii
ʵ��iii
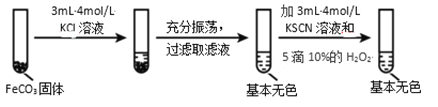
(4)�Ա�ʵ�颢�͢����ó���ʵ�������________��
(5)����ʵ�颢������д������ 10%H2O2 ��Һ�����ӷ���ʽ________��
��.FeCO3��Ӧ��
(6)FeCO3 ���������CH3CH(OH)COOH�����Ƶÿ���������������Ѫ�����˷�Ӧ�����ӷ���ʽΪ____��
(7)��ʵ��С���� KMnO4 �ⶨ��Ѫ�����������������������������������������������������������������Ǵ��� 100%����ԭ����____(�����Dz���������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ͭ��(��Ҫ�ɷ���CuFeS2)������ͭ�ķ�Ӧԭ�����£�

(1)��֪�ڷ�Ӧ�١����о�������ͬ��������ӣ����������Ư���ԡ���ֱ�д����Ӧ�١��ڵĻ�ѧ����ʽ��___________________��__________________��
(2)��̬ͭԭ�ӵĺ�������Ų�ʽΪ________������Ԫ����ȣ���һ�����ܽϴ����________��
(3)��Ӧ�ٺ͢����ɵ�������ӵ�����ԭ�ӵ��ӻ�������________�����ӵĿռ乹����________��
(4)ijѧ��������ͭ��Һ�백ˮ����һ��ʵ�飬CuSO4��Һ�мӰ�ˮ������ɫ�������ټӰ�ˮ�����ܽ⣬�õ�����ɫ����Һ����������Һ�м���һ�����Ҵ�������[Cu(NH3)4]SO4��H2O���壬����ͼ����Ҵ������������ԭ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��120mL����0.20mol̼���Ƶ���Һ��200mL���ᣬ���ܽ�ǰ�ߵ�����ߣ����ǽ����ߵ���ǰ�ߣ�����������������������ɵ����������ͬ���ұ�ֵΪ5��2���������Ũ���ǣ���������
A.2.0mol/LB.1.0mol/LC.0.18mol/LD.1.25mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com