
【题目】对硝基苯甲酸(![]() )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(![]() )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
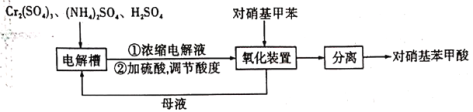
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为__(填“A”或“B”),反应II的离子方程式为_______。
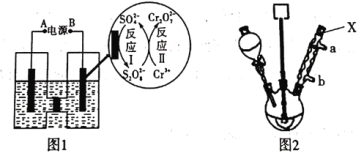
(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是_____,冷却水应从___口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是_____。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是______。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用_____法完成。
⑤该合成技术的优点是实现了____(填化学式)的循环利用,绿色环保。
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为_____。
第一次 | 第二次 | 第三次 | 第四次 | |
体积( mL) | 23.00 | 23.10 | 21.40 | 22.90 |
【答案】A 3S2O82-+2Cr3++7H2O=6SO42-+Cr2O72-+14H+ 冷凝管 b 对硝基苯甲酸 使未反应的对硝基甲苯凝固析出 升华 Cr2(SO4)3、(NH4)2SO4、H2SO4 92.00%
【解析】
用图1装置电解Cr2(SO4)3、(NH4)2SO4、H2SO4的混合液,获得Cr2O72-的电解液,其中阳极区发生氧化反应,然后将含Cr2O72-的电解液浓缩并加硫酸酸化,再在氧化装置内将对硝基甲苯氧化为对硝基苯甲酸,将反应混合物冷却至室温后,与适量冰水充分混合,抽滤,所得所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得对硝基苯甲酸粗产品,据此分析解题。
(1)电解槽中阳极周围阴离子发生氧化反应,反应Ⅰ是SO42-氧化为S2O82-,则右侧电极为阳极,B为外接电源正极,A为外接电源的负极;反应II是S2O82-氧化Cr3+生成Cr2O72-,发生反应的离子方程式为3S2O82-+2Cr3++7H2O=6SO42-+Cr2O72-+14H+;
(2)①仪器X的名称是冷凝管,冷却水的水流方向应与蒸气流向相反,则应从b口进入冷水;
②步骤1中反应液由棕红色变为墨绿色时,说明有对硝基苯甲酸生成,则步骤2经冷却后,经抽滤所得固体的主要成分是对硝基苯甲酸;
③对硝基甲苯的熔点为51.7℃,则步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤,目的是使未反应的对硝基甲苯凝固析出,可提高对硝基苯甲酸的纯度;
④对硝基苯甲酸是黄色晶体,能升华,则对粗产品进行纯化还可以采用升华法完成;
⑤由工业流程图可知,步骤2中抽滤后的滤液返回电解槽中重新电解,说明滤液中的Cr2(SO4)3、(NH4)2SO4、H2SO4可循环利用,符合绿色环保;
(3)第三次实验消耗KOH的体积明显偏小,舍去,其它三次消耗KOH溶液体积的平均值![]() mL=23.00mL,对硝基苯甲酸与KOH溶液发生中和反应时,对硝基苯甲酸与KOH等物质的量反应,则对硝基苯甲酸的纯度为
mL=23.00mL,对硝基苯甲酸与KOH溶液发生中和反应时,对硝基苯甲酸与KOH等物质的量反应,则对硝基苯甲酸的纯度为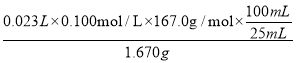 ×100%=92.0%。
×100%=92.0%。


科目:高中化学 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L1硫酸钾溶液中阴离子所带电荷数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。下图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(I)和(II)所示。试回答:
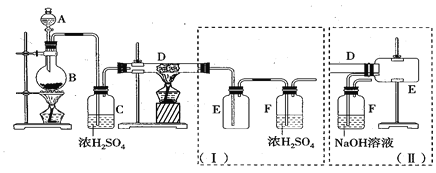
(1)A仪器的名称是_____________________;
(2)B中反应![]() 离子方程式为______________________;其中浓盐酸表现出的性质为________;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________;
离子方程式为______________________;其中浓盐酸表现出的性质为________;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________;
(3)气体通过装置C![]() 目的是________________;
目的是________________;
(4)D中的反应开始前,需进行的操作是___________,应采取的方法是__________________;
(5)写出最佳方法鉴别D中产物的离子方程式:__________________________________________;
(6)装置(I)的主要缺点是_______________________________________________;
(7)如果选用(II)装置来完成实验,则必须采取的改进措施是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶体积的关系如图所示,由此确定,原溶液中含有的阳离子是:( )

A.Mg2+、Al3+、Fe2+B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“充电5秒钟,使用半个月”的石墨烯电池目前正处于实验研发阶段。它是利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性制作的一种新型二次电池。其工作原理如图所示,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2。下列关于该电池的说法不正确的是( )
C6+LiCoO2。下列关于该电池的说法不正确的是( )
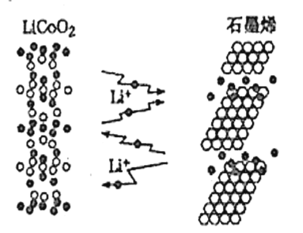
A.充电时,Li+移向石墨烯
B.充电时,转移0.5mol电子理论上阴极材料质量增加3.5g
C.放电时,LiCoO2极发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+
D.对废旧的该电池进行“放电处理”,让Li+从石墨烯中脱出有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的说法,正确的是( )
A.分子式为C5H12的有机物有三种,它们互为同系物
B.C4H8Cl2有9种同分异构体(不考虑立体异构)
C.石蜡油、苯、四氟乙烯都不能使溴水因反应而褪色
D.等物质的量的甲烷与氯气反应后体积保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由物质a为原料,制备物质d(金刚烷)的合成路线如图所示。关于图中有机物说法中错误的是( )
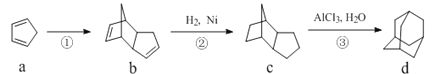
A.物质c与物质d互为同分异构体
B.物质b的分子式为C10H12,既能发生加成反应也能发生取代反应
C.物质a中所有原子都在同一个平面上
D.物质d的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
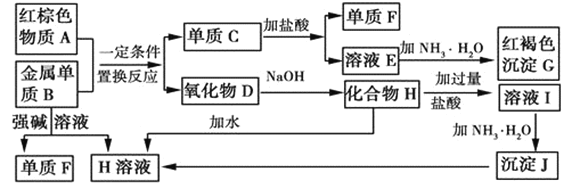
(1)单质F的化学式是___。
(2)写出由沉淀J生成 H溶液的离子方程式__。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:__,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式__。
(4)溶液I中所含金属离子是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com