
(12��) �£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬��ȼ���Ƚϴ���ȼ�ղ���Ի�������Ⱦ���ʿ����������ȼ�ϡ�
��1���¡�����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20����30����KOH��Һ���õ�طŵ�ʱ��ͨ���µ�һ��Ϊ �����ü��ĵ缫��Ӧʽ�� ����ع���һ��ʱ��������Һ��pH�� �����������С���������䡱����
��2���������������������ɵ�����һ���⻯����⻯�����Է�������Ϊ43.0�����е�ԭ�ӵ���������Ϊ0.977��д�����������ᷴӦ�Ļ�ѧ����ʽ ��
��3���º�����������������ƽ��������߷�Ӧ�����ǵ�����ˮ������Ӧ����28.0kg��ԭ����ʱ������μӷ�Ӧ���µ����� (д���������) ��
 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д� �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��12��)ij������Ԫ�ص�ԭ������������Ϊ������2�����䵥�ʼɷ������·�Ӧ����+����+��+ˮ��
��1������ΪNO2���ټ����ҷ�Ӧ�Ļ�ѧ����ʽΪ ��
��NO2���������Ҫȼ�ϡ��£�N2H4������ȼ������֪��
N2(g)+ 2O2(g)��2NO2(g) ��H= +67.7 kJ��mol-1��
2N2H4(g)+ 2NO2(g)��3N2(g) + 4H2O(g) ��H=��1135.7 kJ��mol-1��
д��ȼ�ϡ��£�N2H4��ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ�� ��
��2������ΪSO2��
�ٰ��ҵ�������ͭ���壬�۲쵽�������� ��
��SO2��ʹ����KMnO4��Һ�Ϻ�ɫ��ȥ������������ӷ���ʽ��
MnO4- +
SO2 +
=
Mn2+ +
SO42- +
H+
��SO2��һ�������£�������2SO2(g)+O2(g)2SO3(g) ��H<0��Ӧ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������ʽ������Ӧ��ƽ��ʱ�����ı�����һ������x�������ͼ�����ߵ��� ������ţ���
a��x��ʾ�¶ȣ�y��ʾSO2�����ʵ���
b��x��ʾѹǿ��y��ʾSO2��ת����
c��x��ʾSO2�����ʵ�����y��ʾO2�����ʵ���
d��x��ʾSO3�����ʵ�����y��ʾ��ѧƽ�ⳣ��K
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�����к����ѧ������һ���¿���ѧ�Ծ����������� ���ͣ������
�����12�֣�
��Ԫ�ص��⻯����������ڹ�ҵ�������������ж��й㷺Ӧ�á��ش��������⣺
(1)��Ԫ��ԭ�ӵ�L�������Ϊ ��
(2) NH3��NaClO��Ӧ�ɵõ���(N2H4)���÷�Ӧ�Ļ�ѧ����ʽΪ ��
(3)�¿���Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g) = N2O4(l) ��H1=-19.5kJ?mol��1
��N2H4(l) + O2 (g)=N2(g)+2H2O(g) ��H2 ="-534.2" kJ��mol��1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ ��
(4)��һ����ȼ�ϵ����һ�ּ��Ե�أ��õ�طŵ�ʱ�������ķ�ӦʽΪ ��
��һ��������Һ̬������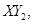 �ڱ�״���µ�һ��������
�ڱ�״���µ�һ��������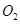 ��ǡ����ȫȼ��,��Ӧ����ʽΪ:
��ǡ����ȫȼ��,��Ӧ����ʽΪ: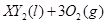 ===
===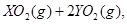 ��ȴ��,�ڱ�״���²��������������672 mL,�ܶ���2.56
��ȴ��,�ڱ�״���²��������������672 mL,�ܶ���2.56 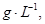 ��:
��:
(1)��Ӧǰ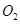 ������� �� (2)������
������� �� (2)������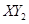 ��Ħ�������� ��
��Ħ�������� ��
(3)��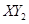 ������X��Y��Ԫ�ص���������3��16,��X��Y��Ԫ�طֱ�Ϊ �� (дԪ�ط���)��
������X��Y��Ԫ�ص���������3��16,��X��Y��Ԫ�طֱ�Ϊ �� (дԪ�ط���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ�������������и�����ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��12��)ij������Ԫ�ص�ԭ������������Ϊ������2�����䵥�ʼɷ������·�Ӧ����+�� ��+��+ˮ��
��+��+ˮ��
��1������ΪNO2���ټ����ҷ�Ӧ�Ļ�ѧ����ʽΪ  ��
��
��NO2���������Ҫȼ�ϡ��£�N2H4������ȼ������֪��
N2(g) + 2O2(g)��2NO2(g) ��H= +67.7 kJ��mol-1��
2N2H4(g) + 2NO2(g)��3N2(g) + 4H2O(g) ��H=��1135.7 kJ��mol-1��
д��ȼ�ϡ��£�N2H4��ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ��  ��
��
��2������ΪSO2��
�ٰ��ҵ�������ͭ���壬�۲쵽�������� ��
��SO2��ʹ����KMnO4��Һ�Ϻ�ɫ��ȥ������������ӷ���ʽ�� MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
��SO2��һ�������£�������2SO2(g)+O2(g) 2SO3(g) ��H< 0��Ӧ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������ʽ������Ӧ��ƽ��ʱ�����ı�����һ������x�������ͼ�����ߵ��� ������ţ���
2SO3(g) ��H< 0��Ӧ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������ʽ������Ӧ��ƽ��ʱ�����ı�����һ������x�������ͼ�����ߵ��� ������ţ���
a��x��ʾ�¶ȣ�y��ʾSO2�����ʵ���
b��x��ʾѹǿ��y��ʾSO2��ת����
c��x��ʾSO2�����ʵ�����y��ʾO2�����ʵ���
d��x��ʾSO3�����ʵ�����y��ʾ��ѧƽ�ⳣ��K
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�����и�����һ���¿���ѧ�Ծ��������棩 ���ͣ������
�����12�֣�
��Ԫ�ص��⻯����������ڹ�ҵ�������������ж��й㷺Ӧ�á��ش��������⣺
(1)��Ԫ��ԭ�ӵ�L�������Ϊ ��
(2) NH3��NaClO��Ӧ�ɵõ���(N2H4)���÷�Ӧ�Ļ�ѧ����ʽΪ ��
(3)�¿���Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g) = N2O4(l) ��H1=-19.5kJ∙mol��1
��N2H4(l) + O2 (g)=N2(g)+2H2O(g) ��H2 =-534.2 kJ��mol��1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ ��
(4)��һ����ȼ�ϵ����һ�ּ��Ե�أ��õ�طŵ�ʱ�������ķ�ӦʽΪ ��
��һ��������Һ̬������ �ڱ�״���µ�һ��������
�ڱ�״���µ�һ�������� ��ǡ����ȫȼ��,��Ӧ����ʽΪ:
��ǡ����ȫȼ��,��Ӧ����ʽΪ: 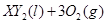 ===
===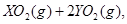 ��ȴ��,�ڱ�״���²��������������672 mL,�ܶ���2.56
��ȴ��,�ڱ�״���²��������������672 mL,�ܶ���2.56  ��:
��:
(1)��Ӧǰ �������
��
(2)������
�������
��
(2)������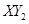 ��Ħ��������
��
��Ħ��������
��
(3)��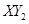 ������X��Y��Ԫ�ص���������3��16,��X��Y��Ԫ�طֱ�Ϊ
��
(дԪ�ط���)��
������X��Y��Ԫ�ص���������3��16,��X��Y��Ԫ�طֱ�Ϊ
��
(дԪ�ط���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���㽭ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��12��)ij������Ԫ�ص�ԭ������������Ϊ������2�����䵥�ʼɷ������·�Ӧ����+�� ��+��+ˮ��
��+��+ˮ��
��1������ΪNO2���ټ����ҷ�Ӧ�Ļ�ѧ����ʽΪ ��
��NO2���������Ҫȼ�ϡ��£�N2H4������ȼ������֪��
N2(g) + 2O2(g)��2NO2(g) ��H= +67.7 kJ��mol-1��
2N2H4(g) + 2NO2(g)��3N2(g) + 4H2O(g) ��H=��1135.7 kJ��mol-1��
д��ȼ�ϡ��£�N2H4��ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ�� ��
��2������ΪSO2��
�ٰ��ҵ�������ͭ���壬�۲쵽�������� ��
��SO2��ʹ����KMnO4��Һ�Ϻ�ɫ��ȥ������������ӷ���ʽ��
 MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
��SO2��һ�������£�������2SO2(g)+O2(g) 2SO3(g) ��H<
0��Ӧ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������ʽ������Ӧ��ƽ��ʱ�����ı�����һ������x�������ͼ�����ߵ��� ������ţ���
2SO3(g) ��H<
0��Ӧ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������ʽ������Ӧ��ƽ��ʱ�����ı�����һ������x�������ͼ�����ߵ��� ������ţ���

a��x��ʾ�¶ȣ�y��ʾSO2�����ʵ���
b��x��ʾѹǿ��y��ʾSO2��ת����
c��x��ʾSO2�����ʵ�����y��ʾO2�����ʵ���
d��x��ʾSO3�����ʵ�����y��ʾ��ѧƽ�ⳣ��K
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com