
| ||
| ||


 智趣暑假温故知新系列答案
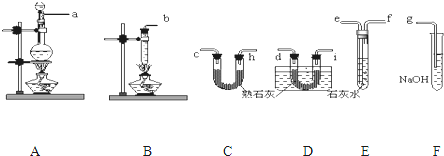
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
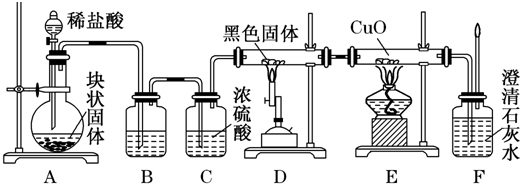
科目:高中化学 来源: 题型:
查看答案和解析>>
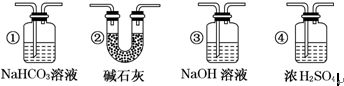
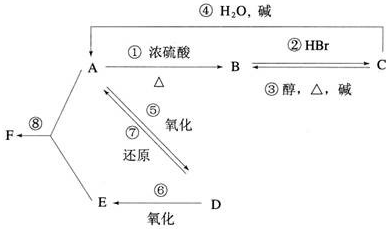
科目:高中化学 来源: 题型:
| 实验变量实验序号 | 银氨溶液 的量/ml | 乙醛的量 /滴 | 水浴温度 /℃ | 反应混合 液的PH | 出现银镜的 时间/min |
| 1 | 2 | 3 | 50 | 11 | T1 |
| 2 | 2 | 3 | 65 | 11 | T2 |
| 3 | 2 | 5 | 65 | 11 | T3 |
| 4 | 2 | 5 | 65 | 4 | 无银镜 |
| 5 | 2 | 5 | 65 | 10 | T4 |
| 6 | 4 | 3 | 50 | 10 | T5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除③外 | B、除③⑤外 |
| C、除③④外 | D、除⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2-Na+ | NaCl | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | ||
C、
| ||
| D、c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com