
【题目】用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是 ( )
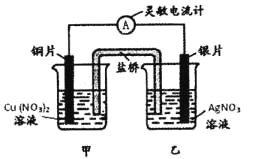
A.电子通过盐桥从乙池流向甲池
B.铜导线替换盐桥,原电池仍继续工作
C.开始时,银片上发生的反应是:Ag—e=Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】电解Na2SO4溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。下列说法正确的是( )
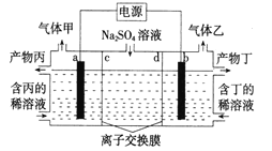
A.b 极与电源的正极相连
B.产物丙为NaOH 溶液
C.离子交换膜d 为阴离了交换膜(允许阴离子通过)
D.a 电极反应式为2H2O-4e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向NaHCO3溶液中加入足量的Ba(OH)2:2HCO3-+Ba2++2OH-=BaCO3↓+ CO32-+2H2O
B.向亚硫酸钠溶液中滴入少量新制的氯水:3SO32-+ Cl2+H2O= SO42-+2Cl-+2HSO3-
C.电解KI溶液阴极电极反应2H2O-4e-= O2↑+4H+
D.Fe2O3固体投入到少量HI溶液中:Fe2O3+6H++6I-=2Fe2++3I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水![]() 含
含![]() 、
、![]() 、
、![]() 、
、![]() 的装置如图所示
的装置如图所示![]() 、b为石墨电极
、b为石墨电极![]() ,下列说法正确的是
,下列说法正确的是
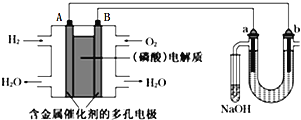
A.电池工作时,B极反应式为![]()
B.电解时,电子流动路径是:A极![]() 外电路
外电路![]() 极
极![]() 溶液
溶液![]() 极
极![]() 极
极
C.NaOH溶液充分吸收后所得溶液可制作漂白水
D.当电池中消耗![]() 标准状况
标准状况![]() 时,a极周围也会产生
时,a极周围也会产生![]() 标准状况
标准状况![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是_____________(写化学式)。
(2)CO可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ/mol
己知:2H2(g)+O2(g)═2H2O(l) △H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g) △H=-483.6kJ`mol-1
①H2的燃烧热为___________________ kJ/mol。
②CH3OH(g)+O2(g)![]() CO(g) +2H2O(g)的反应热△H=___________________。
CO(g) +2H2O(g)的反应热△H=___________________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)![]() CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为 CH3COOCu(NH3)2(aq)+CO(g)![]() CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗常数的值,下列有关说法正确的是
代表阿伏加德罗常数的值,下列有关说法正确的是![]()
![]()
A.![]() 冰醋酸晶体中,含阴离子数目为
冰醋酸晶体中,含阴离子数目为![]()
B.标准状况下,![]() 中含有分子的数目为
中含有分子的数目为![]()
C.常温下,![]() 与
与![]() 混合气体中含分子数为
混合气体中含分子数为![]()
D.![]() 投入
投入![]() 的浓硝酸中,充分反应后转移电子数为
的浓硝酸中,充分反应后转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com