


| 1000ml |
| 20ml |
| 3.36g |
| 10g |


科目:高中化学 来源: 题型:
| A、在标准状况下,NA个任何分子所占的体积约为22.4L |
| B、6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:l |
| C、在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L |
| D、磷酸的摩尔质量(以g/mol为单位)与6.02×1023个磷酸分子的质量(以g为单位)在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C1=C2 |
| B、C1>C2 |
| C、C1<C2 |
| D、C1≥C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
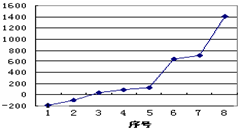 (1)第三周期8种元素按单质熔点高低的顺序
(1)第三周期8种元素按单质熔点高低的顺序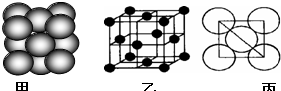
查看答案和解析>>
科目:高中化学 来源: 题型:

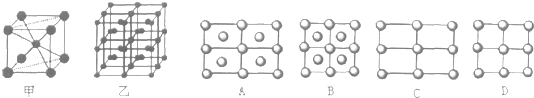
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com