
| A. | 明矾溶于水能形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| B. | 氧化镁熔点高,可用于耐高温材料 | |
| C. | 碳酸钠具有碱性,可用于胃酸中和剂 | |
| D. | 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁 |
分析 A.氢氧化铝具有吸附性,不具有氧化性,不能杀菌消毒;
B.耐高温材料熔点较高;
C.碳酸钠碱性较强;
D.依据铝热反应用途解答.
解答 解:A.明矾溶于水能形成氢氧化铝胶体,具有吸附性,能够吸收水中固体杂质颗粒,可以净水,不具有氧化性,不用于自来水的杀菌消毒,故A错误;
B.氧化镁熔点高,可以做耐高温材料,故B正确;
C.碳酸钠碱性较强,不能用于治疗胃酸过多,故C错误;
D.铝能置换出氧化铁中的铁,可以用于焊接钢轨,但是考虑到经济性问题,所以不用于钢铁工业中大量冶炼铁,故D错误;
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,明确相关物质的结构组成与性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇和浓硫酸混合加热至140℃,CH3CH2OH$→_{140℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| B. | 1-溴丙烷与氢氧化钠的乙醇溶液供热:CH3CH2CH2Br+NaOH$→_{△}^{乙醇}$CH3CH2CH2OH+NaBr | |
| C. | 苯酚钠溶液中通入少量的CO2:2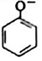 +H2O+CO2→2 +H2O+CO2→2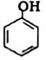 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 乙醛在碱性条件下被新制的氧化铜氧化:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+CuO↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 该温度下此反应的平衡常数K=1.44 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大 | |
| D. | 0~2min的平均速率ν(Z)=2.0×10-3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| B. | 标准状况下,11.2 L由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
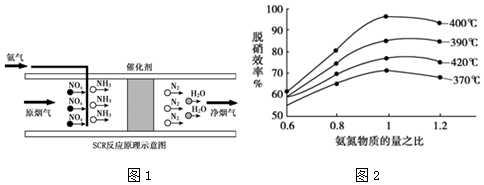
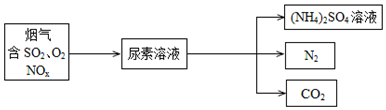
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
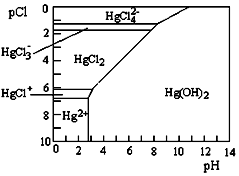 Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )| A. | 配制Hg(NO3)2溶液时,为了防止Hg2+水解,应将Hg(NO3)2固体溶于浓硝酸后再稀释 | |
| B. | 当c(Cl-)=0.1 mol•L-1,pH<8时,汞元素主要以HgCl3-形式存在 | |
| C. | HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3- | |
| D. | 当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液中OH-向电极a移动 | |
| B. | O2在电极b上发生还原反应 | |
| C. | 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O | |
| D. | 反应消耗的NH3与O2的物质的量之比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>②>③>① | B. | ④>③>②>① | C. | ②>③>①>④ | D. | ③>②>①>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com