
| A. | ①③⑤⑦ | B. | ①②③⑦ | C. | ①⑦ | D. | ②④⑥⑧ |
分析 ①根据纯净物的组成考虑,同种元素组成的纯净物为单质,不同元素组成的纯净物为化合物;
②电解质的强弱和溶液导电性无直接关系,是根据电解质的电离程度,而不是导电性;
③分散系本质区别是依据颗粒直径大小不同分为溶液、浊液和胶体;
④根据反应中的能量变化,将化学反应分为放热反应和吸热反应;
⑤酸性氧化物是指和碱反应生成盐和水的氧化物,反应为复分解反应;
⑥过氧化钠是离子化合物,过氧化氢是共价化合物,Na2O2中含有离子键和非极性共价键,H2O2中含有极性共价键和非极性共价键,氧元素成-1价,都能作供氧剂;
⑦浓硫酸、浓硝酸具有强的氧化性,冷的条件下,能够与铁发生反应生成致密的氧化膜,阻止反应继续进行;
⑧明矾中的Al3+水解显酸性,氢氧化铝具有净水作用,次氯酸盐具有氧化性.
解答 解:①纯净物分为单质和化合物,故①正确;
②电解质的强弱是根据电解质的电离程度,水溶液中全部电离的电解质属于强电解质,部分电离的电解质为弱电解质,而不是导电性,导电性强的不一定死强电解质,导电性弱的不一定是弱电解质,故②错误;
③根据分散系的微粒直径大小,将分散系分为溶液、浊液和胶体,丁达尔效应是胶体的特征性质,故③错误;
④根据反应中的能量变化,将化学反应分为放热反应和吸热反应,依据反应特征将化学反应分为“化合、分解、复分解、置换”四类化学反应故④错误;
⑤CO2和SiO2都是酸性氧化物,NO2 和碱反应发生的是氧化还原反应,不是酸性氧化物,二氧化碳不是大气污染物,二氧化硅是固体,NO2 是大气污染物
,故⑤错误;
⑥Na2O2、H2O2所含化学键不同,前者含有离子键和非极性共价键,后者中含有极性共价键和非极性共价键,氧元素成-1价,都能作供氧剂,故⑥错误;
⑦浓硫酸、浓硝酸具有强的氧化性,冷的条件下,能够与铁铝发生反应生成致密的氧化膜,发生钝化,均能用铁罐储运,故⑦正确;
⑧明矾中的Al3+水解显酸性,加入酚酞试液不变色,氢氧化铝具有净水作用,次氯酸盐具有氧化性,故⑧错误;
故选C.
点评 本题主要考查物质的分类、物质性质、化学反应能量变化、化学反应分类、盐类水解、物质结构等知识点,题目难度不大,注意物质的分类的依据,不同的分类标准会得出不同的分类结果,净水与杀菌消毒的区别.


科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 含AlO2-的溶液中:Na+、K+、NO3-、Al3+ | |
| D. | 含大量Fe3+的溶液中:K+、Na+、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
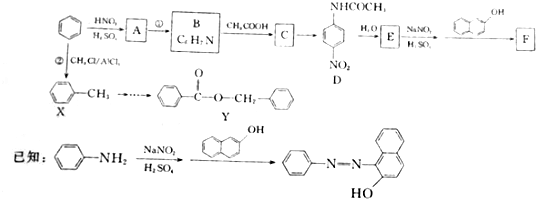
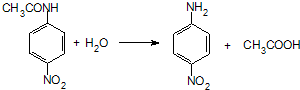
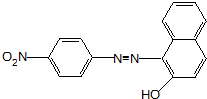
 、
、
 (写出符合要求的所有结构简式)
(写出符合要求的所有结构简式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
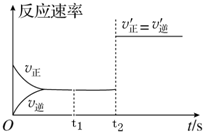 在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)?2CO(g).
在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)?2CO(g).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g石墨中含有C-C键的个数为1.5NA | |
| B. | 60g SiO2中含有Si-O键的个数为2NA | |
| C. | 18g冰中最多含有4 NA个氢键 | |
| D. | 标准状况下,11.2 L CHCl3中含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,若产生的气体使澄清石灰水变浑浊,则溶液一定含有CO32- | |
| B. | 用铂丝蘸取少量某溶液进行颜色反应火焰呈黄色,则该溶液中一定不含K+ | |
| C. | 向某溶液中先加氯水再加KSCN溶液 溶液呈血红色,则原溶液中定含Fe2+ | |
| D. | 浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理各不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
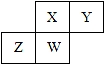 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | 元素Y、Z形成的化合物是制造光电池的主要材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com