
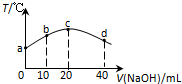
 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-) | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
分析 A、HNO2的电离是吸热过程,温度越高电离平衡常数越大;
B、b点得到HNO2,和NaNO2混合溶液显酸性,说明电离大于水解,由此分析解答,也可能结合电荷守恒分析;
C、a→c温度升高说明两者恰好完全中和,点两者恰好完全反应,而c→d温度降低,所水解为主;
D、d点混合溶液中当c(NaOH)较大时,得到NaOH和NaNO2混合溶液.
解答 解:A、HNO2的电离是吸热过程,温度越高电离平衡常数越大,而c高于b,所以电离平衡常数:c点>b点,故A正确;
B、b点得到HNO2,和NaNO2混合溶液显酸性,说明电离大于水解,所以离子浓度大小为:c(NO2-)>c(Na+)>c(H+)>c(OH-),故B错误;
C、a→c温度升高说明两者恰好完全中和,点两者恰好完全反应,而c→d温度降低,所水解为主,所以c点得到NaNO2溶液是强碱弱酸盐,水解溶液呈碱性,所以c(OH-)>c(HNO2),故C正确;
D、d点混合溶液中当c(NaOH)较大时,得到NaOH和NaNO2混合溶液,所以离子的浓度为:c(Na+)>c(OH-)>c(NO2-)>c(H+),故D正确;
故选B.
点评 本题是根据图象分析离子的浓度之间的关系,解题的关键是根据图象中温度的变化来确定,确定物质的反应实质是解题的关键.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:多选题
| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| B. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
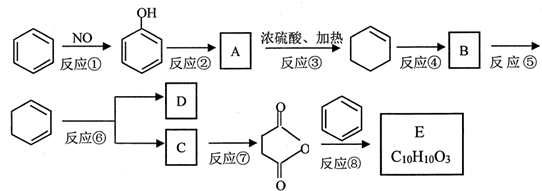
 +(CH3CO)2O→
+(CH3CO)2O→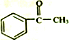 +CH3COOH
+CH3COOH ;B
;B .
. 直接制取
直接制取 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.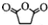 +
+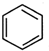 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$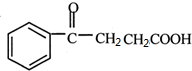 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
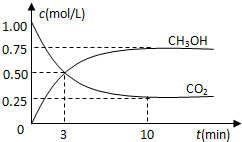 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 进行到3分钟时,正反应速率和逆反应速率相等 | |
| B. | 10分钟后容器中各物质浓度不再改变 | |
| C. | 达到平衡后,升高温度,正反应速率增大、逆反应速率减小 | |
| D. | 3min前v正>v逆,3min后v正<v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl是强酸而H2SO3是弱酸 | B. | HClO4的酸性比H2SO4强 | ||
| C. | H2S比HCl稳定 | D. | H2SO4比HClO酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
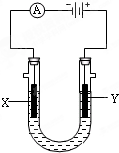 电解原理在化学工业中有广泛应用.
电解原理在化学工业中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙 | |
| B. | 对苯二甲酸(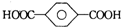 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (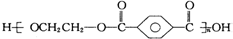 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. | 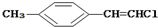 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com