
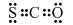 ;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol
;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol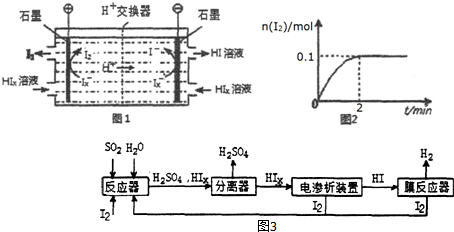
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,COS和二氧化碳为等电子体,等电子体微粒的结构相似;
(2)焦亚硫酸钠遇水后立即生成一种酸式盐为亚硫酸氢钠;
(3)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,配平书写方程式,若仅在SO2的水溶液中滴加几滴碘水,会发生氧化还原反应,亚硫酸根离子被氧化为硫酸根离子,$\frac{[S{{O}_{3}}^{2-}]}{[HS{{O}_{3}}^{-}]}$=$\frac{Ka}{[{H}^{+}]}$;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,阳极区的H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI;
③由图可知,2min内H2物质的量的变化量,根据反应方程式写平衡表达式,结合平衡浓度计算平衡常数,若将HI通入量变为原来的4倍,反应前后气体体积不变,平衡不变,氢气所占体积分数即为氢气物质的量的分数.
解答 解:(1)COS和二氧化碳为等电子体,等电子体微粒的结构相似,所以该气体的电子式为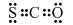 ;
;
①SO2(g)+2CO(g)═2C02(g)+$\frac{1}{x}$Sx(s)△H=a kJ•mol-1;
②2COS(g)+SO2(g)═2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ•mol-1.
依据盖斯定律(②-①×2)÷2得到:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol,
故答案为: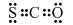 ;xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol;
;xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol;
(2)焦亚硫酸钠遇水后立即生成一种酸式盐为亚硫酸氢钠,反应的化学方程式为Na2S2O5+H2O=2NaHSO3 ,
故答案为:Na2S2O5+H2O=2NaHSO3 ;
(3)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为SO2+x I2+2H2O═H2SO4+2HIX,若仅在SO2的水溶液中滴加几滴碘水,会发生氧化还原反应,亚硫酸根离子被氧化为硫酸根离子,$\frac{[S{{O}_{3}}^{2-}]}{[HS{{O}_{3}}^{-}]}$=$\frac{[S{{O}_{3}}^{2-}][{H}^{+}]}{[HS{{O}_{3}}^{-}][{H}^{+}]}$=$\frac{Ka}{[{H}^{+}]}$,反应过程中氢离子浓度增大,电离平衡常数不变,则比值减小,
故答案为:SO2+x I2+2H2O═H2SO4+2HIX;减小;
②由图2可知,H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx$\frac{\underline{\;电解\;}}{\;}$ (x-1)I2+2HI,
故答案为:2HIx$\frac{\underline{\;电解\;}}{\;}$ (x-1)I2+2HI;
③若向膜反应器中加入1molHI,反应为2HI?H2+I2,结合平衡三行计算列式计算,图象可知2min达到平衡状态,氢气物质的量为0.1mol,
2HI?H2+I2,
起始量(mol/L) 1 0 0
变化量(mol/L) 0.2 0.1 0.1
平衡量(mol/L) 0.8 0.1 0.1
反应前后气体体积不变,平衡常数可以利用物质的量代替平衡浓度计算,K=$\frac{0.1×0.1}{0.{8}^{2}}$=$\frac{1}{64}$,
若将HI通入量变为原来的4倍,反应前后气体体积不变,平衡不变,氢气所占体积分数即为氢气物质的量的分数=$\frac{0.1mol}{1mol}$×100%=10%,
故答案为:$\frac{1}{64}$;10%.
点评 本题考查盖斯定律计算、离子浓度大小比较、电解原理等,侧重于学生的分析能力的考查,为高考常见题型,题目难度中等,注意利用守恒思想比较溶液中微粒浓度大小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| B. | 氨气具有还原性,可用作制冷剂 | |
| C. | Na2O2呈浅黄色,可用作潜水艇中的供氧剂 | |
| D. | 氧化铝的熔点高,可用于制造耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “洁净煤技术”研究在世界上相当普遍.
“洁净煤技术”研究在世界上相当普遍.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com