
 、
、 、
、 ;C6H5OCH3.
;C6H5OCH3. 科目:高中化学 来源: 题型:选择题
| A. | 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2NA | |
| B. | 71g氯气通入足量的水中,反应中转移的电子总数为NA | |
| C. | 由D和18O所组成的水11g,所含的中子数为4NA | |
| D. | 1molBrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大最共存 | |
| B. | 在含有0.1mol/L Fe3+的溶液中:SCN-、Cl-、K+不能大最共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-变化最小 | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
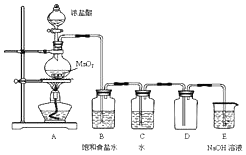 某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.
某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
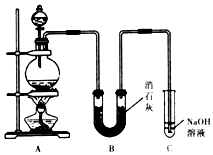 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题:
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题: MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O CaCl2+Ca(ClO)2+2H2O
CaCl2+Ca(ClO)2+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com