
室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如下图所示。下列说法错误的是( )
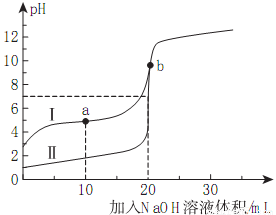
A.当Ⅰ代表HB,b点时体系中有:c(B-)+c(HB)=0.05mol/L
B.滴定分析中,甲基橙不能用做滴定曲线Ⅰ中的指示剂
C.a点时的溶液中离子浓度最大的是c(Na+)
D.若Ⅱ代表HA的滴定曲线,则Ka(HB)≈10-5
科目:高中化学 来源:2015-2016学年江苏省高一下期中化学试卷(解析版) 题型:选择题
有A,B两种烃,含碳的质量分数相等。关于A和B的下列叙述正确的是
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B的最简式相同
D.A和B各1 mol完全燃烧后生成CO2的质量一定相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:实验题
某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物,请回答下列问题:

请回答下列问题:
(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从 口进入(填“a”或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是 。
(3)能说明苯与液溴发生了取代反应的现象是 。
(4)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中,这样操作的目的是 ,简述这一操作的方法: 。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;⑤ (填操作名称)。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:实验题
某化工厂以天然气、水、空气为基本原料联合生产氨、硝酸,获得了良好的经济效益,下面是其生产流程图。
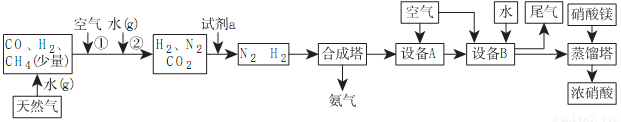
(1)试剂a可能是________,设备B的名称为_________,设备A中的化学方程式为____________。
(2)该化工厂合成氨时的压强40MPa,温度为500℃左右,在此条件下,测定达到平衡时混合气体中NH3的体积分数约为35.2%。
①在保持温度、压强不变的情况下,写出一种能提高合成塔中H2转化率的方法____________,温度越低,NH3的产率越高,为何不在较低温度下进行合成____________。
②从合成塔中出来的NH3的体积分数通常约为15%,其原因是____________。
(3)从设备B中出来的硝酸浓度较小,通常先加入一定量的硝酸镁后再进行蒸馏
①下列可以代替硝酸镁加入到蒸馏塔中的是:____________
A.浓硫酸B.硫酸镁C.生石灰
②蒸馏时通常采用减压蒸馏,这样做的主要目的是____________。
(4)用尿素[CO(NH2)2]处理尾气时可得到纯净的两种常见无毒气体,反应过程为:NO、NO2在水中反应转化亚硝酸,然后亚硝酸再与尿素反应,写出后者反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:填空题
氧元素能形成众多的化合物,其中有一些化合物具有特殊的组成与性质。
(1)H2O2、D2O、D2O2中化学性质彼此相似的物质是_________,OF2是一种棕黄色有恶臭的气体,有极强的氧化性,则OF2中氧元素的化合价为________,将F2通入稀的NaOH溶液中可得到OF2、盐等物质,相应反应的化学方程式为____________。
(2)研究表明,H2O2相当于二元弱酸,有较强的还原性
①H2O2的一级电离方程式为_________,已知常温下1L的H2O2相当于48.3mol,其一级电离平衡常数K约为1.67×10-12,则该温度下H2O2中c(H+)约为_________,写出它与足量Ba(OH)2反应的化学方程式________。
②过氧化氢、镁合金可构成镁燃料电池,放电时总反应:Mg+2H++H2O2=Mg2++2H2O,则放电时的正极反应为_________。
(3)氧也能与钾元素形成K2O、K2O2、KO2、KO3等氧化物,其中KO2是一种比Na2O2效率高的供氧剂,写出它与CO2反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
某溶液中可能含有物质的量浓度相等的下列离子中的几种:Fe3+、Cu2+、Na+、SO42-、CO32-、NO3-、Cl-、I-,取上述溶液少量分别进行如下实验:①一份中加入少量锌粉后,固体溶解、溶液颜色有变化,但无其它现象产生②一份加入BaCl2溶液后得到白色沉淀,下列有关判断正确的是( )
A.溶液中只含Fe3+、SO42-、Cl-
B.溶液中只含Cu2+、SO42-
C.需要利用焰色反应才能确定有无Na+
D.溶液中肯定没有I-,但无法确定有无Cl-
查看答案和解析>>
科目:高中化学 来源:2016届江西省、临川二中高三下联考理综化学试卷(解析版) 题型:填空题
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)溴的价电子排布式为 ;PCl3的空间构型为
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ•mol﹣1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在s﹣pσ键,也不存在p﹣pπ键的是
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为 ,写出CO的等电子体的微粒 (写出1个)。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 .已知该氧化物的密度是ρg•cm﹣3,则晶胞离得最近的两个钙离子间的距离为 cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下学期周考五理科综合化学试卷(解析版) 题型:选择题
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )

A.N电极上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CH0+H2O
C.M电极上的电极反应式为:2Cl--2e-═Cl2↑
B.若有2molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1mol
D.乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁鞍山一中高二下期中化学试卷(解析版) 题型:选择题
除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是
选项 | 含杂质的物质 | 试剂 | 除杂方法 |
A | CH4(C2H4) | Br2水 | 洗气 |
B | C6H6(Br2) | Fe粉 | 蒸馏 |
C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
D | C2H2(H2S) | CuSO4溶液 | 洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com