
| A. | 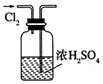 干燥C12 | B. | 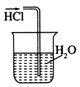 吸收HCl | ||
| C. | 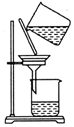 除去粗盐中的不溶物 | D. | 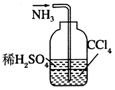 吸收NH3 |
分析 A.干燥时导管应长进短出;
B.HCl极易溶于水,导管在液面下可发生倒吸;
C.过滤时漏斗下端尖端应紧靠烧杯内壁;
D.四氯化碳与水分层,且在下层,隔绝气体与水.
解答 解:A.干燥时导管应长进短出,图中气体的进入方向不合理,故A错误;
B.HCl极易溶于水,导管在液面下可发生倒吸,图中装置可发生倒吸,故B错误;
C.过滤时漏斗下端尖端应紧靠烧杯内壁,图中操作不规范,故C错误;
D.四氯化碳与水分层,且在下层,隔绝气体与水,则图中装置可吸收NH3,并能防止倒吸,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、实验技能、物质的性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K随压强的改变而改变 | B. | K越大,C的平衡浓度越小 | ||
| C. | C的起始浓度越大,K值越大 | D. | K越大,反应进行的程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 少量的钠可以保存煤油中,如果露置在空气中会迅速和氧气反应生成过氧化钠 | |
| C. | 钠长期放罝在空气中,最终将变成碳酸钠 | |
| D. | 当钠与硫酸铜溶液反应时,有大量蓝色沉淀出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质 | |
| C. | 取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质 | |
| D. | 测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3═Fe3++Cl3- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | KMnO4═K++Mn7++4O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:Ca2+、Na+、PO43-、NO3- | |
| B. | 0.1 mol•L-1Na2S溶液中:Ag+、Fe3+、NO3-、Cl- | |
| C. | 无色溶液中:K+、H+、Cl-、MnO4- | |
| D. | 0.1 mol•L-1 NaOH溶液中:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 转化率 压强 | 500K | 600K |
| P | 60% | b |
| 1.5P | a | 55% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com