
已知下列元素的电负性数值:N—3.04,H—2.20,F—4.00,O—3.44,B—2.04,Cl—3.16,In—1.78。则下列叙述中正确的是( )
A.N—F键的极性>N—H键的极性
B.O—H键的极性<F—O键的极性
C.In—Cl键的极性<B—Cl键的极性
D.N—H键的极性>B—Cl键的极性
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列反应无论怎样调整反应物的用量,都只能生成一种物质的是( )
A.甲烷与氯气混合后在光照的条件下发生反应
B.乙烯与氯化氢的加成反应
C.甲苯与Br2发生反应
D.乙炔与氢气的加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应式为2CH3OH+3O2+4OH-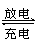
 2CO
2CO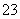 +6H2O,则下列有关说法错误的是( )
+6H2O,则下列有关说法错误的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应式为CH3OH-6e-+8OH-===CO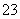 +6H2O
+6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)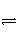
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________________________________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应是否达到化学平衡状态的依据是________(填字母序号)。
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.分子的结构是由键长决定的
B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C.CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等
D.H2O分子中2个O—H键夹角为180°
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v (X)(C)
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v (X)(C)
A. v(NH3)=0.0100mol·L-1·s-1
B. v (O2)=0.0010mol·L-1·s-1
C. v (NO)=0.0010mol·L-1·s-1
D. v (H2O)=0.045mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应A(s)+2B(g) C(g)+D(g)已达平衡的是()
C(g)+D(g)已达平衡的是()
A. 混合气体的压强
B. 混合气体的密度
C. B的物质的量浓度
D. 气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。下列有关的判断正确的是()
A. a为负极、b为正极
B. a为阳极、b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com