
| 选 项 | A | B | C | D |
| 实验操作或装置 | 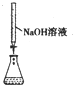 | 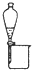 | 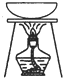 |  |
| 实验目的 | 准确量取25.00mLNaOH溶液 | 分离乙醇与乙酸乙酯 | 从KI和I2的混合物中回收I2 | 实验室制取SO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸式滴定管只能量取酸性溶液,碱式滴定管只能量取碱性溶液;
B.互溶且沸点相差较大的液体应该采用蒸馏方法分离,互不相溶的液体采用分液方法分离;
C.碘易升华,加热时碘生成碘蒸气,该实验无法回收碘;
D.浓硫酸和亚硫酸钠反应生成二氧化硫,二氧化硫密度大于空气,应该采用向上排空气法收集.
解答 解:A.酸式滴定管只能量取酸性溶液,碱式滴定管只能量取碱性溶液,所以NaOH溶液应该用碱式滴定管量取,故A错误;
B.互溶且沸点相差较大的液体应该采用蒸馏方法分离,互不相溶的液体采用分液方法分离,乙醇和乙酸乙酯互溶,应该采用蒸馏方法分离,故B错误;
C.碘易升华,加热时碘生成碘蒸气,该实验无法回收碘,所以无法实现实验目的,故C错误;
D.浓硫酸和亚硫酸钠反应生成二氧化硫,二氧化硫密度大于空气,应该采用向上排空气法收集,所以能实现实验目的,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,涉及仪器的选取、物质分离和提纯、气体制备和收集等,易错选项是C.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:多选题
| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷、新戊烷、异戊烷互为同分异构体 | |
| B. | 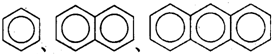 互为同系物 互为同系物 | |
| C. | 四氯乙烯分子中所有原子都处于同一平面 | |
| D. | 扁桃酸(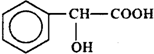 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
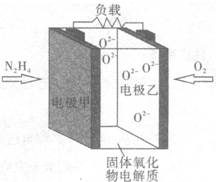 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为N2H4+2O2═2NO+2H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 探究化学反应的限度:取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中即含I2又含I-的实验事实判断该反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com