
| A. | a=4 | |
| B. | S2O32-是氧化剂 | |
| C. | Y的化学式为Fe3O4 | |
| D. | 当有1 molO2参加反应时,转移电子的物质的量为4 mol |
分析 从电荷守恒的角度分析,6-4-a=-2,所以a=4.可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Y+S4O62-+2H2O,根据铁元素和氧元素守恒,可知Y为Fe3O4,所以该离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O.
A、根据电荷守恒计算a的值;
B、根据S元素的化合价分析;
C、根据铁元素和氧元素守恒,可知Y为Fe3O4;
D、当有1 molO2参加反应时,反应中只有O2中氧元素化合价降低,据此计算.
解答 解:从电荷守恒的角度分析,6-4-a=-2,所以a=4.可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Y+S4O62-+2H2O,根据铁元素和氧元素守恒,可知Y为Fe3O4,所以该离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O.
A、从电荷守恒的角度分析,6-4-a=-2,所以a=4,故A正确;
B、反应中S元素的化合价从+2价升高到+2.5价,则S2O32-是还原剂,故B错误;
C、根据铁元素和氧元素守恒,可知Y为Fe3O4,故C正确;
D、当有1 molO2参加反应时,反应中只有O2中氧元素化合价降低由0价降低为-2价,所以转移电子数为4mol,故D正确.
故选:B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用菜籽油浸泡花椒制得花椒油的过程未发生化学变化 | |
| B. | 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用 | |
| C. | 把浸泡过KMnO4溶液的硅藻土放在水果箱里可延长水果的保鲜期 | |
| D. | 对医疗器械高温消毒时,病毒蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

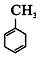 的官能团名称为碳碳双键.
的官能团名称为碳碳双键. 的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
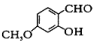 中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.
中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.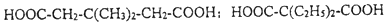 .
.
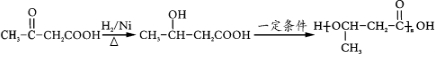 .(无机试剂任用)
.(无机试剂任用)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X被氧化,Y 是氧化剂 | B. | Y被还原,X是氧化剂 | ||
| C. | X是还原剂,Y被氧化 | D. | Y被还原,X2+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某水溶液X中只可能含有Al3+、CO32-、Cl-、SiO32-、SO42-、Fe2+中的若干种离子.某同学对该溶液进行了如下实验:
某水溶液X中只可能含有Al3+、CO32-、Cl-、SiO32-、SO42-、Fe2+中的若干种离子.某同学对该溶液进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④⑤ | C. | ④⑥ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com