

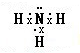 ,在高温高压催化剂条件下氨气被氧化生成NO和水,反应方程式为:4NH3+5O2
,在高温高压催化剂条件下氨气被氧化生成NO和水,反应方程式为:4NH3+5O2
| ||
| 高温高压 |
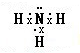 ;4NH3+5O2
;4NH3+5O2
| ||
| 高温高压 |


科目:高中化学 来源: 题型:
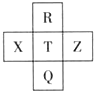 五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )
五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )| A、Z为Cl |
| B、非金属性:X<T |
| C、原子半径:R<T<Q |
| D、最高价氧化物的水化物的酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)电镀时,镀件与电源的
(1)电镀时,镀件与电源的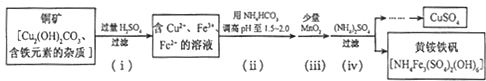
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
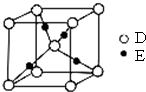 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
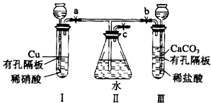 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fe2++4I-+3Cl2→2Fe3++2I2+6Cl- |
| B、2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- |
| C、2Fe2++2I-+2Br-+3Cl2→2Fe3++I2+Br2+6Cl- |
| D、2Fe2++4I-+4Br-+5Cl2→2Fe3++2I2+2Br2+10Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
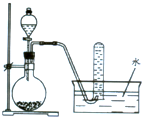
| A、用锌和盐酸制取H2 |
| B、用NH4Cl和Ca(OH)2制取NH3 |
| C、用电石和饱和食盐水制取C2H2 |
| D、用H2O2在MnO2催化下制O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com