


科目:高中化学 来源: 题型:
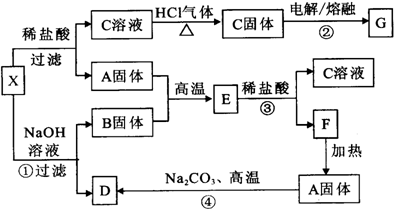 下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.查看答案和解析>>
科目:高中化学 来源: 题型:
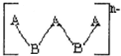 主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是( )
主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是( )| A、n=2 |
| B、A是第ⅡA族元素 |
| C、A为-2价,B为+2价 |
| D、该离子没有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ① | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 铁的质量/g | 铁的形态 | c(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度 | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:
硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度/mol.L-1 时间/min |
c(CO) | c(H2) | c(CH3OH) |
| 0 | 1.0 | 2.0 | 0 |
| 2 | 0.8 | 0.2 | |
| 4 | 1.0 | 0.5 | |
| 6 | 1.0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ga3N2 |
| B、Ga2N3 |
| C、GaN |
| D、Ga3N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com