
 ;
; ,故答案为:
,故答案为: ;
; ,甲烷的结构式为
,甲烷的结构式为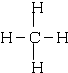 ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: ;
;| 一定条件 |
| 一定条件 |
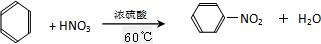 ,
, ;取代反应.
;取代反应.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| T/K | 673 | 773 | … |
| K | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾可用来净水 |
| B、一束平行光线照射蛋白质溶液时,从一侧可以看到光亮的通路 |
| C、FeCl3溶液中滴入NaOH溶液,出现红褐色沉淀 |
| D、Al(OH)3或Fe(OH)3胶体可以吸附水中的悬浮颗粒而沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4(g)+
| ||
| B、在25℃、101kPa,1mol硫和2mol硫的燃烧热相等 | ||
| C、CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | ||
| D、101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com