
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,转移1 mol电子时阴极增加的质量为103.5 g | |
| C. | 放电时,BF4-向PbO2电极移动 | |
| D. | 放电时,正极的电极反应式为Pb+2e-+2H2O═Pb2++4OH- |
分析 原电池的总反应为:Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极.据此分析.
解答 解:A.充电时,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,产生大量氢离子,故阳极附近溶液的酸性增强,pH减小,故A错误;
B.放电时负极反应为:Pb-2e-=Pb2+,转移1mol 电子,阴极生成0.5mol Pb,即增重103.5g,故B正确;
C.放电时,BF4-向负极移动,故C错误;
D.由总反应可知放电时,正极发生还原反应,电极反应式为PbO2+2e-+4H+═pb2++2H2O,故D错误;
故选B.
点评 本题考查了原电池中电极反应式的书写和离子移动方向的判断,为高频考点,应注意的是在原电池中,阴离子移向负极,阳离子移向正极;在电解池中,阴离子移向阳极,阳离子移向阴极.


科目:高中化学 来源: 题型:选择题
| A. | 正反应的速率为零 | B. | SO2完全转化为SO3 | ||
| C. | SO3的物质的量浓度不再变化 | D. | SO2、O2和SO3的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和时所需KOH 的量 | B. | CH3COOH电离程度 | ||
| C. | H+的物质的量浓度 | D. | CH3COOH的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同素异形体 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H互为同位素 | |
| C. | CH2═CH2和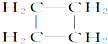 互为同系物 互为同系物 | |
| D. | 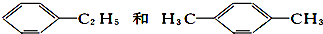 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
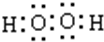 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=4,n=2 | B. | m=4,n=5 | C. | m=3,n=3 | D. | m=5,n=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
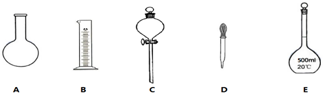
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池不能用水溶液作为电解质 | |
| B. | 阳极产生的气体为Cl2和O2 | |
| C. | 电解后该溶液的pH=2 | |
| D. | 电源正极的电极反应式为:FeS2+4e-═Fe+2S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com