
| 实验操作 | 答案 | 实验现象 |
| ①让一束光线通过Fe(OH)3胶体 | A、呈蓝色 B、生成白色胶状沉淀 C、呈现光亮“通路” D、产生红褐色沉淀 | |
| ②向盛有FeCl3溶液的试管中加入NaOH溶液 | ||
| ③向Al2(SO4)3溶液中滴加氨水 | ||
| ④向土豆片上滴加碘水 |

| 8.4g |
| 84g/mol |


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
| 实验编号 | 盐酸的浓度/(mol/L) | MOH溶液的浓度/(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | 0.2 | c1 | 7 |
| 丙 | 0.1 | 0.1 | 5 |
| A、甲组混合溶液中M+水解程度较丙组中大,且a<5 |
| B、甲组混合溶液中:c(Cl-)>c(M+)>c(H+)>c(OH-) |
| C、乙组混合溶液中:c(M+)+c(MOH)>0.1mol/L,且c1>0.2 |
| D、丙组混合溶液中:c(OH-)+c(MOH)=10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa溶液中 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、NaHS溶液中:c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下图是元素周期表短周期中11种元素的化台价与原子序数的关系示意图,请回答下列问题(用具体的元素符号作答):
下图是元素周期表短周期中11种元素的化台价与原子序数的关系示意图,请回答下列问题(用具体的元素符号作答):查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
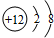 ,该离子的符号为
,该离子的符号为查看答案和解析>>
科目:高中化学 来源: 题型:
 1、欲用98%的浓硫酸(ρ=1.84g?cm-3)配制成浓度为0.25mol?L-1的稀硫酸500mL.
1、欲用98%的浓硫酸(ρ=1.84g?cm-3)配制成浓度为0.25mol?L-1的稀硫酸500mL.| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、野火烧不尽,春风吹又生 |
| B、爆竹声中一岁除,春风送暖入屠苏 |
| C、粉身碎骨浑不怕,要留清白在人间 |
| D、春蚕到死丝方尽,蜡炬成灰泪始干 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com