
 A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题:
A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题: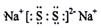 ,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.
,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.分析 A、B、C、D、E、F是分属三个短周期的主族元素,原子序数依次增大,则A为H元素;A、D同主族,结合D的原子序数大于B、C可知D为Na元素;B的氢化物水溶液呈碱性,该氢化物为氢气,则B为N元素;C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一,EC2为SO2,则C为O、E为S元素;F的原子序数大于S,且为短周期元素,则F为Cl元素,据此进行解答.
解答 解:A、B、C、D、E、F是分属三个短周期的主族元素,原子序数依次增大,则A为H元素;A、D同主族,结合D的原子序数大于B、C可知D为Na元素;B的氢化物水溶液呈碱性,该氢化物为氢气,则B为N元素;C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一,EC2为SO2,则C为O、E为S元素;F的原子序数大于S,且为短周期元素,则F为Cl元素,
(1)F为Cl元素,原子序数为17,位于周期表中第三周期第ⅦA族,
故答案为:第三周期第ⅦA族;
(2)常温下,液态的B2A4(N2H4)与气态的BC2(NO2)与发生反应生成无毒物质,该产物为氮气,2molN2H4(64g)完全燃烧放出热量为:akJ×$\frac{64g}{16g}$=4akJ,该反应的热化学方程式为:2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l)△H=-4akJ/mol,
故答案为:2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l)△H=-4akJ/mol;
(3)D2E为Na2S,Na2S在空气中长期放置发生反应,生成物之一为H,H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的化学式为Na2S2,Na2S2为离子化合物,其电子式为: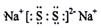 ;Na2S在空气中长期放置生成Na2S2的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2;类比过氧化钠的性质可知,Na2S2的溶液与稀硫酸反应生成硫酸钠、S单质,则溶液由黄色变为无色,产生浅黄色沉淀和气体产生,
;Na2S在空气中长期放置生成Na2S2的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2;类比过氧化钠的性质可知,Na2S2的溶液与稀硫酸反应生成硫酸钠、S单质,则溶液由黄色变为无色,产生浅黄色沉淀和气体产生,
故答案为: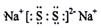 ;4Na2S+O2+2H2O=4NaOH+2Na2S2;溶液由黄色变为无色,产生浅黄色沉淀和气体产生;
;4Na2S+O2+2H2O=4NaOH+2Na2S2;溶液由黄色变为无色,产生浅黄色沉淀和气体产生;
(4)A4B4为H4N4,一定条件下1mol H4N4熔融电离生成两种离子各1mol,生成的离子为NH4+、N3-,则该离子化合物为NH4N3,其电离方程式为:NH4N3$\frac{\underline{\;熔融\;}}{\;}$NH4++N3-,
故答案为:NH4N3$\frac{\underline{\;熔融\;}}{\;}$NH4++N3-;
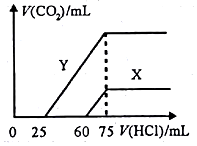
(5)由A、B、C、D中三种元素形成一元强碱为NaOH,曲线X、Y,开始没有气体,加入一定体积盐酸后生成气体,生成气体的反应为:HCO3-+H+=H2O+CO2↑,再结合反应OH-+H+=H2O、H++CO32-=HCO3-可知,若X中只有Na2CO3,开始发生CO32-+H+=HCO3-,前后两过程消耗HCl的体积相等,而实际开始阶段消耗盐酸体积大于产生二氧化碳消耗的盐酸体积,故X曲线表明M中的溶质为NaOH、Na2CO3,Y曲线中,前后消耗盐酸的体积之比为1:3,则曲线Y表明M中溶质为Na2CO3、NaHCO3,且二者物质的量之比为1:2,根据钠元素守恒可知,当加入75mL盐酸时,溶液中的溶质为氯化钠,所以原溶液中的氢氧化钠的物质的量 为0.1mol/L×0.075L=0.0075mol,所以氢氧化钠的物质的量浓度为:$\frac{0.0075mol}{0.03L}$=0.25mol/L,曲线X生成二氧化碳消耗盐酸体积为(75-60)mL=15mL,曲线Y生成二氧化碳消耗盐酸体积为(75-25)mL=50mL,由HCO3-+H+=H2O+CO2↑可知,则两次实验通入的CO2的体积之比=15mL:50mL=3:10,
故答案为:NaHCO3和Na2CO3;0.25mol/L;3:10.
点评 本题考查原子结构与元素周期律的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律的关系,(5)为易错点,注意根据图象曲线变化分析M的组成,试题知识点较多、综合性较强,充分考查了学生的分析能力及综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 该电池的电解质溶液为酸性 | B. | 电池总反应为2H2+O2=2H2O | ||
| C. | X极是负极,发生氧化反应 | D. | 电池工作一段时间后溶液PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+Ba2+=BaCO3 | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-→H2O+BaCO3 | |
| D. | 2HCO3-+Ba2++OH-=BaCO3+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
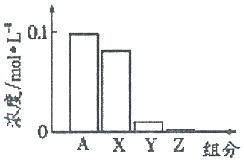 常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )
常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )| A. | A代表Na+浓度 | |
| B. | 该溶液中c(OH-)>c(Y) | |
| C. | 向该溶液中加水稀释,所有离子浓度均减小 | |
| D. | 该混合溶液中:c(X)+c(Y)+c(Z)═2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
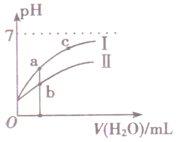 如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 等浓度等体积的CH3COONa和NaClO两种溶液中,阴离子的总物质的量前者小于后者 | |
| C. | 图中a、b两点对应的酸的物质的量浓度a>b | |
| D. | 图中a、c两点的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 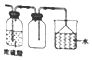 利用图收集干燥的氯化氢气体 | |
| B. | 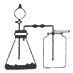 选择合适的试剂,利用图2可分别制取并收集少量CO2、NO和O2 | |
| C. |  利用图可验证铁发生吸氧腐蚀 | |
| D. |  利用图蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 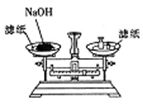 称取一定的NaOH | |
| B. | 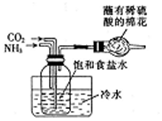 制取Na2CO3 | |
| C. | 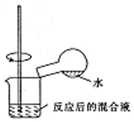 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 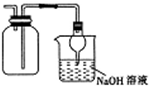 收集NO2并防止其污染环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
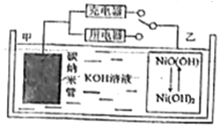 氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )
氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 可开发氢燃料电池用于电动汽车 | |
| C. | 电池总反应为H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2 | |
| D. | 充电时,乙电极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向含Ag2S固体的溶液中滴加少量Na2S溶液,c(Ag+)、c(S2-)、Ksp(Ag2S)都减小 | |
| B. | 常温下,pH=10的K2CO3溶液和pH=4的FeCl3溶液中,水的电离程度后者小 | |
| C. | 含KHSO3和K2SO3的中性混合溶液中有c(K+)=c(HSO3-)+2c(SO32-) | |
| D. | 常温下,将pH=2的HX溶液稀释1000倍,稀释后溶液的pH一定为5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com