
| A.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Cl-+2Fe3+ |
| B.大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| C.向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| D.为了除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理:Ca2++CO32-═CaCO3↓ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.NaHCO3的电离方程式为:NaHCO3=Na++H++CO32- |
| B.金属氧化物不一定是碱性氧化物 |
| C.在碱性溶液中能大量共存的离子为:Fe3+、Na+、Cl-、SO42- |
| D.SO3溶于水,其水溶液能导电,SO3是电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.用氢氧化钡溶液中和硫酸溶液:Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓ |
| C.二氧化硅与氢氧化钠反应:SiO2+2OH-=SiO32-+H2O |
| D.石灰石中加入盐酸:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3溶液与Na2S溶液混合:2Fe3++3S2-+3H2O═2Fe(OH)3↓+3H2S↑ | ||||
B.用铜做电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| C.NaHS电离方程式:NaHS?Na++HS- | ||||
| D.NH4Cl水解反应:NH4++2H2O?NH3?H2O+H3O+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.84消毒液与洁厕灵混合可能产生毒气:ClO-+Cl-+2H+═Cl2↑+H2O |
| B.用二氧化硅和水反应可制得硅酸:SiO2+H2O═H2SiO3 |
| C.食醋与蛋壳反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D.铁在氯气中燃烧:Fe+Cl2═FeCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、SO42—、OH—、K+ | B.Fe3+、Cl—、NO3—、H+ |
| C.K+、CO32—、Cl—、H+ | D.H+、Na+、Cl—、SO42— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数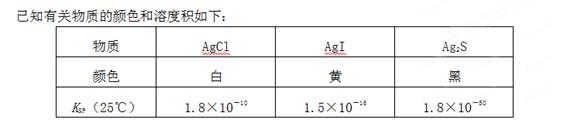

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
B.由水电离的c (H+)="1" ×10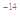 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c (Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- |
| D.c (H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中,Fe3+、I-、NO3-、K+可以大量共存 |
B.在c(SO )=0.1 mol·L-1的溶液中,Na+、Cl-、H+、Ca2+可以大量共存 )=0.1 mol·L-1的溶液中,Na+、Cl-、H+、Ca2+可以大量共存 |
| C.工业上用过量的NaOH溶液吸收SO2:SO2 + OH- ="=" HSO3- |
| D.将AlCl3溶液滴入NaOH溶液中反应的离子方程式:Al3+ + 4OH- = AlO2- + 2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com