
选考[化学——选修3:物质结构与性质] (13分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的价电子排布式 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号),上述方程式中涉及到的N、O、P、S元素第一电离能由小到大的顺序为 。及电负性由小到大的顺序为 。
(2)氨基乙酸铜的分子结构如图,氮原子的杂化方式为 。
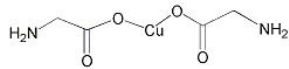
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为 。
(4)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。

选考[化学——选修3:物质结构与性质] (13分)
(1)3d10 4s1 (1分) K Cr (2分)
S<P< O<N (2分) P<S<N<O(2分)
(2) sp3 (2分) (3)1:2 (2分) (4)CuH (2分)
【解析】
试题分析:(1)Cu的外围电子即是价电子,其排布式为3d10 4s1;Cu原子的最外层电子数是1,与Cu原子的最外层电子数相等且属于同周期的元素还有K、Cr元素;元素的第一电离能随电子层数的增多而减小,随核电荷数的增多而增大,N原子的2p轨道为半充满的稳定状态,所以其第一电离能大于O,同理P>S,O、N是第二周期元素,P、S是第三周期元素,则四种元素的第一电离能的顺序是S<P< O<N,而电负性不存在反常情况,元素的电负性随电子层数的增多而减小,随核电荷数的增多而增大,则四种元素的电负性的关系是P<S<N<O;
(2)N原子的周围有3个σ键,一对孤对电子,所以杂化方式为sp3;
(3)CN-与N2是等电子体,结构相似,存在C、N三键,所以CN-中的σ键与π键的数目之比1:2;
(4)共价晶胞图可知,该晶胞中Cu原子的个数是12×(1/6)+2×(1/2)+3=6;H原子个数是6×(1/3)+1+3=6,所以Cu:H=1:1.故该化合物的化学式为 CuH。
考点:考查物质的结构与性质的应用


科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
下表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是

A.常温常压下,五种元素的单质中有两种是气态
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.质子数为92、中子数为143的铀(U)原子: 92235U
B.过氧化氢的电子式: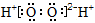
C.氯离子的结构示意图: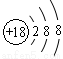
D.1,3—二甲基丁烷:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:填空题
【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体 C.硫酸钠溶液 D.纯碱溶液
II、合成氨的流程示意图如下:

回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液。 | 溶液变成血红色 | 溶液中含有Fe2+ |
B | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫红色 | 碘在CCl4中的溶解度较大 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是


A.上述气体检测时,敏感电极均作电池正极
B.检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C.检测H2S时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测Cl2时,敏感电极的电极反应式为:Cl2 + 2e-= 2Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g) 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K=
B.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大
C.增大该体系的压强,A的转化率增大
D.该条件下B的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:选择题
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中物质 | b中物质 | c中收集气体 | d中物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓NaOH | 铝屑 | H2 | H2O |
C | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
D | 浓硝酸 | Cu | NO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
随着化学工业的发展,各种化学合成材料已经进入我们寻常百姓家庭,下列关于生活中常用材料的认识,准确的是
A.尼龙、羊毛和棉花都是天然纤维
B.现在生产的各种塑料在自然条件下都不可以降解
C.由酚醛树脂制成的插座破裂后可以热修补
D.装食物的聚乙烯塑料袋可以通过加热进行封口
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com