
| A. | 第IIA族中无非金属元素 | B. | 第IA族金属元素单质均能与水反应 | ||
| C. | 元素种类最多的族是第VIII族 | D. | 金属元素的种类比非金属元素多 |
分析 A.第IIA族为碱土金属元素;
B.第IA族金属元素单质,具有强还原性;
C.第IIIB族含锕系、镧系元素;
D.在已经发现的一百余种元素中,金属元素的种类远比非金属元素的种类多.
解答 解:A.因第IIA族为碱土金属,均为金属,无非金属元素,故A正确;
B.第IA族元素中金属单质能与水反应生成氢气,故B正确;
C.第IIIB族含锕系、镧系元素,元素的种类最多,故C错误;
D.一百余种元素中,非金属元素有22种,则金属元素的种类远比非金属元素的种类多,故D正确;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素位置、性质的关系为解答的关键,注意锕系元素、镧系元素的位置,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
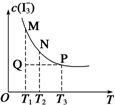 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )| A. | 反应速率:vM>vP | B. | 平衡常数:KN<KP | ||
| C. | M、N两点相比,M点的c(I-)大 | D. | Q点时,v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com