
| A、Na+、K+、SO42-、NO3-、Cl- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Ca2+、K+、OH-、Cl-、NO3- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8[来源:www.shulihua.net] | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 已知:
已知:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑤⑥ | B、②③④⑥ |
| C、①③④⑤ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为C20H16N2O5 |
| B、可用FeCl3溶液检验该物质是否发生水解 |
| C、该物质可与9mol H2发生加成反应 |
| D、一定条件下,1mol分别消耗Na、NaOH、Na2CO3的比值为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHCO3 溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | ||||
B、向NH4HCO3 溶液中加过量NaOH 溶液并加热:NH4++OH-
| ||||
| C、将过量二氧化硫气体通入氨水中:SO2+NH3?H2O═HSO3-+NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++3NO3-═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

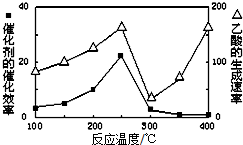
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol?L-1 |
| B、1.0 mol?L-1 |
| C、2.0 mol?L-1 |
| D、3.0 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com