

分析 实验室用加热二氧化锰与浓盐酸的方法制取氯气,二者反应生成氯化锰、氯气和水,浓盐酸易挥发,制备的氯气中混有氯化氢、水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,然后依次通过干燥有色布条,湿润有色布条,验证干燥的氯气无漂白性,湿润的氯气具有漂白性,再用浓硫酸干燥,干燥的氯气与铜在F中反应生成氯化铜,最后进行尾气吸收.
(1)F中反应条件需要加热,则通入F中的气体应进行干燥;
(2)依据铜与氯气反应生成氯化铜产物及现象解答;
(3)依据二氧化锰只有浓盐酸反应,与稀盐酸不反应解答.
解答 解:(1)F中反应条件需要加热,则通入F中的气体应进行干燥,所以E中浓硫酸的作用防止F中的水蒸气进入D中;
故答案为:防止F中的水蒸气进入D中;
(2)铜与氯气反应生成氯化铜,看到的现象为:铜丝剧烈燃烧,产生棕黄色的烟;
故答案为:铜丝剧烈燃烧,产生棕黄色的烟;
(3)二氧化锰只有浓盐酸反应,与稀盐酸不反应,浓盐酸具有挥发性,加热能够促进其挥发,反应中随着盐酸的消耗,导致盐酸的浓度降低变为稀盐酸,稀盐酸与二氧化锰不反应,所以制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,
故选:AB.
点评 本题以氯气的制取及性质为载体综合考查实验的相关知识,主要考查氯气的制备、净化、性质验证、尾气处理及实验安全等基础知识,熟悉氯气制备原理及性质是解题关键,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
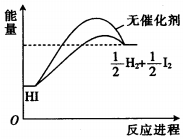
| A. | 加入催化剂,减小了反应的活化能 | |
| B. | 加入催化剂,可提高HI的平衡转化率 | |
| C. | 降低温度,HI的分解速率加快 | |
| D. | 反应物的总能量大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35 C1和37Cl | B. | CH3CH2CH2 CH3和CH (CH3)3 | ||
| C. | CH3CH3和CH3CH2CH3. | D. | H2O和H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体可用于净水 | B. | Fe2O3可用作红色涂料 | ||
| C. | 纯碱溶液可用于去除油污 | D. | MnO2和浓HCl可用于工业制氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;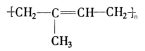 其单体的结构简式CH2=C(CH3)CH=CH2;
其单体的结构简式CH2=C(CH3)CH=CH2;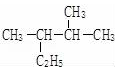 的名称(系统命名法)2,3-二甲基戊烷.
的名称(系统命名法)2,3-二甲基戊烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com