
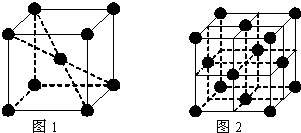
4
| ||
| 3 |
4
| ||
| 2 |
4
| ||
| 3 |
4
| ||
| 2 |
| ||
| 3 |
| ||
| 3 |
| 1 |
| 8 |
4
| ||
| 3 |
| 2×56 | ||||
NA×(
|
| 1 |
| 8 |
| 1 |
| 2 |
4
| ||
| 2 |
| 4×56 | ||||
NA×(
|
3
| ||
| 8 |
3
| ||
| 8 |


科目:高中化学 来源: 题型:
| A、①③ | B、②④ |
| C、②③④⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
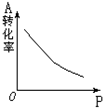 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:查看答案和解析>>
科目:高中化学 来源: 题型:
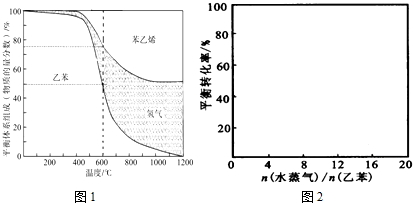
| n(水蒸气) |
| n(乙苯) |
| n(水蒸气) |
| n(乙苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol?L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com