
| A、钢管与电源正极连接,可对钢管进行电化学保护 |
| B、利用高压氧舱治疗煤气中毒是依据平衡移动原理 |
| C、配制氯化亚锡(SnCl2)溶液时需加适量盐酸防止被氧化变浑浊 |
| D、用Fe除去溶液中的Cu2+、Hg2+与用FeS除去溶液中的Cu2+、Hg2+的原理相同 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

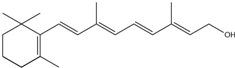
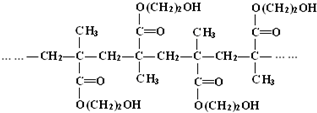
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、洗净的容量瓶未经干燥就用于配制溶液 |
| B、未等溶液降至室温就转移至容量瓶 |
| C、转移溶液时不慎洒到容量瓶外 |
| D、定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴入酚酞显红色的溶液:Na+、Al3+、SO42-、Cl- | ||
| B、滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42- | ||
C、
| ||
D、c(H+)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某芳香烃分子式为C9H12,其苯环上的一氯代物有两种的同分异构体有3种 |
| B、用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 |
C、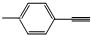 分子中所有原子共平面 分子中所有原子共平面 |
D、1.0 mol 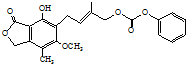 最多能与4.0 mol NaOH水溶液完全反应 最多能与4.0 mol NaOH水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 醋酸浓度(mol?L-1) | 1 | 0.1 | 0.01 |
| pH值 | 2.50 | 3.00 | 3.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com