
【题目】将四氯化碳加入浓碘水中,碘水的颜色变浅,这是由于发生了( )
A.化学反应B.取代反应C.加成反应D.萃取过程
科目:高中化学 来源: 题型:
【题目】下列反应对应的离子方程式正确的是
A. MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
C. Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
D. 明矾溶于水产生Al(OH)3胶体:Al3++3H2O = Al(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于H2S和SO2的说法正确的是______________
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.两气体按体积比1:2 混合可完全转化为S
D.将两气体通入溴水或酸性KMnO4溶液中,可通过颜色变化鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO![]() N2+2CO2,现在实验室模拟上述反应,己知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,己知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内CO的反应速率为_________________ 。
②该反应平衡常数______________(保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________(填“正向”、“逆向”或“不”)移动。判断理由是_________________。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某NaOH稀溶液中c(H+)=10a mol/L,c(OH)=10b mol/L,已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数KW=__________________。
(2)NaOH的物质的量浓度为_________________,由水电离出的c(OH)为______________。
(3)给该NaOH溶液降温,pH________(填“变大”、“变小”或“不变”)。
(4)该温度下,将pH=3的H2SO4与pH=11的NaOH等体积混合,则混合后溶液的pH=____(已知lg2=0.3) (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定是碱性的是 ( )
A. 溶液中c(OH-)>c(H+) B. c(OH-)>1×10-7mol/L
C. 溶液中含有OH- D. pH=8的某电解质的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( ) 
A.该反应是放热反应
B.该反应是氧化还原反应
C.该反应过程中有共价键的断裂和形成
D.使用催化剂可以改变反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某容器中充入N2和H2合成NH3,以下叙述错误的是( )
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后减小为零
C.随着反应的进行,逆反应速率逐渐增大,最后保持恒定
D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将1.0L c molL-1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入少量CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是
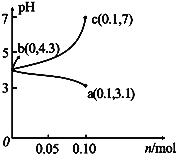
A. 水的电离程度:c>b>a
B. a点对应的混合溶液中,c(CH3COOH)>c(Na+ )>c(OH-)
C. 当混合溶液呈中性时,c(Na+ )=c(CH3COO-)>c(H+) =c(OH-)
D. 该温度下,醋酸的电离平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com