
【题目】铁是地壳中含量非常丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参加的两个反应的化学方程式: ________________。
(2)写出赤铁矿被![]() 还原成铁的化学方程式:__________________________。
还原成铁的化学方程式:__________________________。
(3)实验室中可用![]() 还原
还原![]() ,在加热
,在加热![]() 前应先_________,否则可能发生________现象;未反应完的
前应先_________,否则可能发生________现象;未反应完的![]() ___________(填“能”或“不能”)排放到大气中,应做________处理。
___________(填“能”或“不能”)排放到大气中,应做________处理。
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
![]() 用
用![]() 催化还原氮氧化物可以消除氮氧化物的污染。已知:
催化还原氮氧化物可以消除氮氧化物的污染。已知:
![]()
![]()
![]()
![]()
![]()
![]()
请写出![]()
![]() 与
与![]()
![]() 反应生成
反应生成![]()
![]() ,
,![]() 和
和![]() 的热化学方程式__________。
的热化学方程式__________。
![]() 用活性炭还原法处理氮氧化物。有关反应为:
用活性炭还原法处理氮氧化物。有关反应为:![]()
![]() ,某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温
,某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温![]() 条件下反应,反应进行到不同时间测得各物质的浓度如下:
条件下反应,反应进行到不同时间测得各物质的浓度如下:
NO |
|
| |
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
40 |
|
|
|
50 |
|
|
|
![]() 下列说法不能作为判断该反应达到化学平衡状态标志的是_______
下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A 活性炭的质量 ![]()
C 容器内压强保持不变 ![]() 容器内混合气体的密度保持不变
容器内混合气体的密度保持不变
E 容器内混合气体的平均相对分子质量保持不变
F 容器内![]() 的浓度保持不变
的浓度保持不变
![]() 在
在![]() 时,该反应的平衡常数为_________
时,该反应的平衡常数为_________![]() 小数点后保留两位有效数字
小数点后保留两位有效数字![]() ;
;
![]() 在
在![]() 时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
![]() 在
在![]() 时保持温度和容器体积不变再充入NO和
时保持温度和容器体积不变再充入NO和![]() ,使二者的浓度均增加至原来的两倍,则化学平衡_______
,使二者的浓度均增加至原来的两倍,则化学平衡_______![]() 填“正向移动”、“逆向移动”或“不移动”
填“正向移动”、“逆向移动”或“不移动”![]()
![]() 利用反应
利用反应![]() 构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
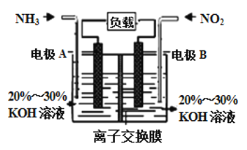
A电极的电极反应式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求表示下列有机物:
①相对分子质量为72且沸点最低的烷烃的结构简式:____。
②顺-2-丁烯的结构简式:____________。
③某炔烃经催化加氢后可得到2-甲基丁烷,则该炔烃的名称是(按系统命名法命名):______。
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%。已知该物质可与FeCl3溶液发生显色反应,则X的分子式为_____;若1molX与浓溴水反应时可消耗3molBr2,则X的结构简式为_____。
(3)按要求写出下列反应的化学方程式:
①实验室制备乙炔的化学方程式:__________。
②2-溴丙烷与氢氧化钠水溶液共热的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
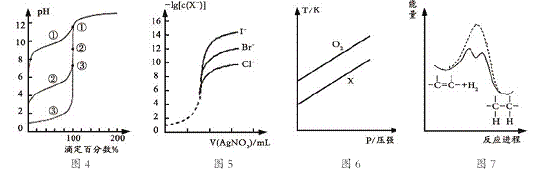
A.用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L Cl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C.在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D.由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3 具有净水作用,请回答下列问题:
(1)FeCl3净水的原理是_____________(用离子方程式表示)。
(2)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_____。
(3)工业上由CuCl2·2H2O晶体制备无水CuCl2的合理方法是在HCl气氛中加热,若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_________ (用化学方程式表示)。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:①取0.36 g试样溶于水,加入过量KI固体,发生反应:2Cu2++4I- = 2CuI↓+I2,生成白色沉淀。②用0.100 0 mol·L-1Na2S2O3标准溶液滴定生成的I2,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(已知:I2+2S2O32- = S4O62-+2I-)
①滴定过程可选用________作指示剂,滴定终点时的现象是_______________________。
②该试样中CuCl2·2H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
A. v(A)=0.15molL﹣1s﹣1B. v(B)=0.6molL﹣1s﹣1
C. v(C)=0.5molL﹣1s﹣1D. v(D)=0.4molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一种钯催化的交叉偶联反应可以表示为:
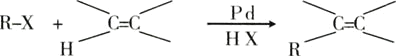
硝基还原为氨基: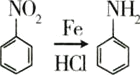
下面是利用钯催化的交叉偶联反应,以烯烃A(含两个甲基)与苯为原料合成L(相对质量不超过200)的过程,其中F在浓硫酸作用下可以发生两种不同的反应分别形成H和G。
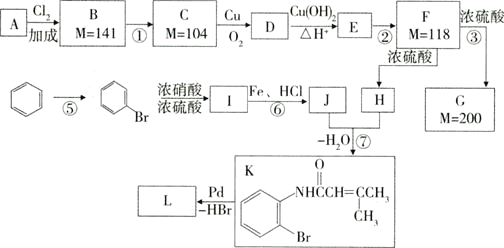
(1)写出反应的反应类型:④___⑥___。
(2)写出反应需要的无机反应物、反应条件:①___⑤___;
(3)J中所含官能团的名称__,__。
(4)根据要求完成下列两个空格:
用系统命名法给物质A命名:__;写出物质L的结构简式:__。
(5)写出下列反应的化学方程式:
C→D:___。
D与新制的Cu(OH)2__。
F→G:___。
(6)H有多种同分异构体,请写出一种符合下列条件的结构简式:__。
ⅰ.能发生水解反应
ⅱ.分子中只含有两个甲基
ⅲ.不含环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的![]() 的原子和价电子排布为4s24p5的原子
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
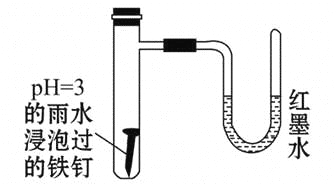
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com