
| A. | 由ZR组成的化合物为离子化合物 | B. | 含氧酸酸性R>X | ||
| C. | X、Y只能共存于共价化合物中 | D. | 原子半径Z>R>Y>X |
分析 X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C;Y元素在地壳中含量最多,则Y为O;Z元素金属性最强,则Z为Na;R原子的核外电子数是X、Z核外电子数之和,R原子核外电子数为6+11=17,故R为Cl,由此分析解答.
解答 解:X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C;Y元素在地壳中含量最多,则Y为O;Z元素金属性最强,则Z为Na;R原子的核外电子数是X、Z核外电子数之和,R原子核外电子数为6+11=17,故R为Cl.
A.由ZR组成的化合物是氯化钠,氯化钠为离子化合物,故A正确;
B.碳酸的酸性比HClO的酸性强,故B错误;
C.C、O可能共存于离子化合物中,如碳酸钠等,故C错误;
D.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径Z(Na)>R(Cl)>X(C)>Y(O),故D错误;
故选:A.
点评 本题考查结构性质位置关系应用,A、B选项为易错点,A选项中学生容易考虑甲烷,而忽略烃类物质,B选项学生容易根据最高价含氧酸酸性判断.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
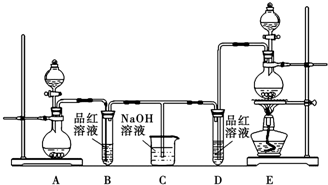
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
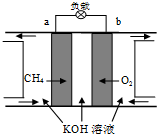 全球气候变暖已经成为全世界人类面临的重大问题.
全球气候变暖已经成为全世界人类面临的重大问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
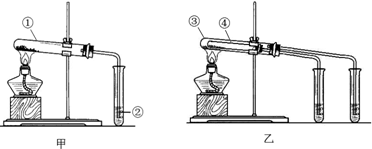
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
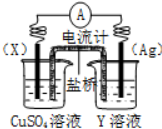 如图蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2
如图蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| B. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| C. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向氯化铝溶液中加入足量氨水:A13++4NH3•H2O═AlO2-+2H2O+4NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com